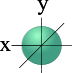При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства.
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.
Квантовые числа электронов.
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число(n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3...) и соответствует номеру периода.
Главное квантовое число имеет значения: n=1,2,3,4 и т.д. К,L,M,N…– буквенное обозначение уровня.
Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Пример.
Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем.
Для
l =0 s- подуровень, s- орбиталь – орбиталь сфера;
l =1 p- подуровень, p- орбиталь – орбиталь гантель;
l =2 d- подуровень, d- орбиталь – орбиталь сложной формы;
l =3 f-подуровень, f-орбиталь – орбиталь еще более сложной формы
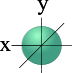
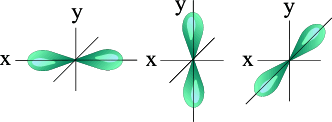
S – орбиталь Три p – орбитали
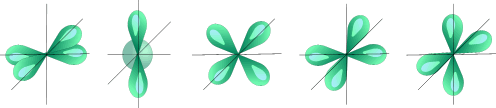
Пять d – орбиталей
Ещё до появления модели Бора физики научились различать в спектрах близко расположенные линии, отличающиеся по внешнему виду. Одни из них (очень узкие) получили название «резких» (от англ. sharp). Наиболее яркие линии назвали «главными» (от англ. principle). Наблюдались более широкие линии –их назвали «размытыми» (diffuse). Ещёодин сорт линий имеет название «фундаментальных» (от англ. fundamental). По первым буквам английских названий говорили о наличии в спектрах испускания s-, p-, d- и f-линий. Применительно к модели Бора это означает, что в спектрах атомов более сложных, чем водород, постоянные электронные уровни могут состоять из нескольких близко расположенных подуровней:
s-подуровень назван по «резкой» (sharp) линии,
p-подуровень назван по «главной» (principal) линии,
d-подуровень назван по «диффузной», «размытой» (diffuse) линии,
f-подуровень назван по «фундаментальной» (fundamental) линии.
На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает единственное значение l = (n - 1) = 0. Форма обитали – сферическая; на первом энергетическом только один подуровень – 1s.
Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения:
l = 0, s-орбиталь– сфера большего размера, чем на первом энергетическом уровне;
l = 1, p-орбиталь– гантель.
Таким образом, на втором энергетическом уровне имеются два подуровня – 2sи 2p.
Для третьего энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения:
l = 0, s-орбиталь– сфера большего размера, чем на втором энергетическом уровне;
l = 1, p-орбиталь– гантель большего размера, чем на втором энергетическом уровне;
l = 2, d-орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня – 3s, 3p и 3d.
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от – l до + l, включая 0. Это означает, что для каждой формы орбитали существует (2 l + 1) энергетически равноценных ориентации в пространстве.
Для s-орбитали (l = 0) такое положение одно и соответствует m= 0. Сфера не может иметь разные ориентации в пространстве.
Для p-орбитали (l = 1) – три равноценные ориентации в пространстве (2 l + 1 = 3): m = -1, 0, +1.
Для d-орбитали (l = 2) – пять равноценных ориентаций в пространстве (2 l + 1 = 5): m= -2, -1, 0, +1, +2.
Таким образом, на s-подуровне –одна, на p-подуровне – три, наd-подуровне –пять, на f-подуровне – 7 орбиталей.
Спиновое квантовое число(s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.