I.Моносахариды.
Из шестиуглеродных моносахаридов – гексоз – важное значение имеют глюкоза, фруктоза и галактоза.
Глюкоза.
Основные понятия. Строение молекулы.
Для установления структурной формулы молекулы глюкозы необходимо знать её химические свойства. Экспериментально доказали, что один моль глюкозы реагирует с пятью молями уксусной кислоты с образованием сложного эфира. Это означает, что в молекуле глюкозы имеется пять гидроксильных групп. Так как глюкоза в аммиачном растворе оксида серебра (II) дает реакцию «серебрянного зеркала», то в её молекуле должна быть альдегидная группа.
Опытным путем так же одказали, что глюкоза имеет неразветвленную углеродную цепь. На основании этих данных строение молекулы глюкозы можно выразить следующей формулой:

Как видно из формулы, глюкоза является одновременно многоатомным спиртом а альдегидом, т.е альдегидоспиртом.
Дальнейшие исследование показали, что кроме молекул с открытой цепью, для глюкозы характерны молекулы циклического строения. Это объясняется тем, что молекулы глюкозы, вследствие вращения атомов углерода вокруг связей могут принимать изогнутую форму и гидроксильная группа 5 углерода может приблизиться к гидроксильной группе. В последней под действием гидроксильной группы разрывается π-связь. К свободной связи присоединяется атом водорода, и образуется шестичленное кольцо, в котором альдегидная группа отсутствует. Доказано, что в водном растворе существуют обе формы молекул глюкозы – альдегидная и циклическая, между которыми устанавливается химическое равновесие:
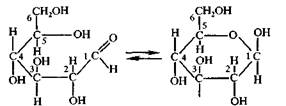
В молекулах глюкозы с открытой цепью альдегидная группа может свободно вращаться вокруг σ-связи, которая находится между первым и вторым атомами углерода. В молекулах циклической формы такое вращение не возможно. По этой причине циклическая форма молекулы может иметь различное пространственное строение:
a) α-форма глюкозы - гидроксильные группы (-ОН) при первом и втором атомах углерода расположены по одну сторону кольца.
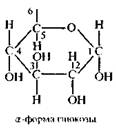
b) б - форма глюкозы - гидроксильные группы находятся по разные стороны кольца молекулы.

Физические свойства.
Глюкоза - бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора кристаллизуется. По сравнению со свекловичным сахаром менее сладкая.
Химические свойства.
Глюкоза обладает химическими свойствами, характерными для спиртов (гидроксильная (-ОН) группа) и альдегидов (группа альдегида (-СНО). Кроме того, она обладает и некоторыми специфическими свойствами.
1. Свойства, характерные для спиртов:
а) взаимодействие с оксидом меди (II):
C6H12O6 + Cu(OH)2 → C6H10O6Cu + H2O
алкоголят меди (II)
б) взаимодействие с карбоновыми кислотами с образованием сложных эфиров (реакция этерификации).
C6H12O6+5CH3COOH→C6H7O6(CH3CO)5
Получение глюкозы.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А.М.Бутлеровым в 1861 году:
са(он)2
6НСОН → С6Н12О6
формальдегид люкоза
На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
Н2SО4
(С6Н10О5)n + nН2О → nC6H12O6
крахмал глюкоза
Применение глюкозы.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям, в результате которых освобождается энергия, которая накопилась в процессе фотосинтеза. Упрощено процесс окисления глюкозы в организме можно выразить следующим уравнением:
С6Н12О6 + 6О2→6СО2+6H2O+Q
Так как глюкоза легко усваивается организмом, ее используют в медицине в качестве укрепляющего лечебного средства. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников).
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же, как при силосований кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
II Дисахариды.
Сахароза.
Основные понятия. Строение молекулы
Опытным путем доказано, что молекулярная формула сахарозы C12H22O11. При исследовании химических свойств сахарозы можно убедиться, что для нее характерна реакция многоатомных спиртов: при взаимодействии с гидроксидом меди (II) образуется ярко-синий раствор. Реакцию «серебряного зеркала» с сахарозой осуществить не удается. Следовательно, в ее молекуле имеются гидроксильные группы, но нет альдегидной.
Но если раствор сахарозы нагреть в присутствии соляной или серной кислоты, то образуются два вещества, одно из которых, подобно альдегидам, реагирует как с аммиачным раствором оксида серебра (I), так и с гидроксидом меди (II). Эта реакция доказывает, что в присутствии минеральных кислот сахароза подвергается гидролизу и в результате образуются глюкоза и фруктоза. Так подтверждается, что молекулы сахарозы состоят из взаимно связанных остатков молекул глюкозы и фруктозы.


Физические свойства.
Чистая сахароза — бесцветное кристаллическое вещество сладкого вкуса, хорошо растворимое в воде.
Химические свойства.
Главным свойством дисахаридов, отличающим их от моносахаридов, является способность к гидролизу в кислой среде (или под действием ферментов в организме):
С12Н22О11+Н2О→ С6Н12О6+ С6Н12О6
сахароза глюкоза фруктоза
Образовавшуюся в процессе гидролиза глюкозу можно обнаружить реакцией «серебряного зеркала» или при взаимодействии ее с гидроксидом меди (II).
Получение сахарозы.
Сахарозу C12H22O11 (сахар) получают в основном из сахарной свеклы и сахарного тростника. При производстве сахарозы не происходят химические превращения, ибо она уже имеется в природных продуктах. Ее лишь выделяют из этих продуктов по возможности в более чистом виде.
Процесс выделения сахарозы из сахарной свеклы:
1. Очищенную сахарную свеклу в механических свеклорезках превращают в тонкую стружку и помещают ее вспециальные сосуды — диффузоры, через которые пропускают горячую воду. В результате из свеклы вымывается почти вся сахароза, но вместе с ней в раствор переходят различные кислоты, белки и красящие вещества, которые требуется отделить от сахарозы.
2. Образовавшийся в диффузорах раствор обрабатывают известковым молоком.
С12Н22О11+Ca(OH)2→ С12Н22О11∙2CaO∙H2O
Гидроксид кальция реагирует с содержащимися в растворе кислотами. Так как кальциевые соли большинства органических кислот малорастворимы, то они выпадают в осадок. Сахароза же с гидроксидом кальция образует растворимый сахарат типа алкоголятов - С12Н22О11∙2CaO∙H2O
3. Чтобы разложить образовавшийся сахарат кальция и нейтрализовать избыток гидроксида кальция, через их раствор пропускают оксид углерода (IV). В результате кальций осаждается в виде карбоната:
С12Н22О11∙2CaO∙H2O + 2СО2 → С12Н22О11 + 2CaСO3↓ 2Н2О
4. Полученный после осаждения карбоната кальция раствор фильтруют, затем упаривают в вакуумных аппаратах и кристаллики сахара отделяют центрифугированием.
Однако выделить весь сахар из раствора не удается. Остается бурый раствор (меласса), который содержит еще до 50% сахарозы. Мелассу используют для получения лимонной кислоты и некоторых других продуктов.
5. Выделенный сахарный песок обычно имеет желтоватый цвет, так как содержит красящие вещества. Чтобы их отделить, сахарозу вновь растворяют в воде и полученный раствор пропускают через активированный уголь. Затем раствор снова упаривают и подвергают кристаллизации. (см. приложение 2)
Применение сахарозы.
Сахароза в основном используется в качестве продукта питания и в кондитерской промышленности. Путем гидролиза из нее получают искусственный мед.
III Полисахариды.
Некоторые углеводы представляют собой природные полимеры, состоящие из многих сотен и даже тысяч моносахаридных звеньев, входящих в состав одной макромолекулы. Поэтому такие вещества получили название полисахариды. Наиболее важными среди полисахаридов являются крахмал и целлюлоза. Оба они образуются в растительных клетках из глюкозы, основного продукта процесса фотосинтеза.
Крахмал
Основные понятия. Строение молекулы.
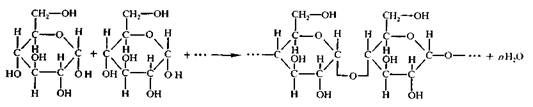
Экспериментально доказано, что химическая формула крахмала (C6H10O5)n, где п достигает нескольких тысяч. Крахмал является природным полимером, молекулы которого состоят из отдельных звеньев C6H10O5. Так как при гидролизе крахмала образуется только глюкоза, то можно сделать вывод, что эти звенья являются остатками молекул α- глюкозы.
Ученым удалось доказать, что макромолекулы крахмала состоят из остатков молекул циклической глюкозы. Процесс образования крахмала можно представить так:
Физические свойства.
Крахмал — белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер. В отличие от моно- и олигосахаридов полисахариды не обладают сладким вкусом.
Химические свойства.
1) Качественная реакция на крахмал.
Характерной реакцией крахмала является его взаимодействие с йодом. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь. Этим свойством пользуются при определении крахмала в пищевых продуктах. Так, например, если каплю йода поместить на срез картофеля или ломтик белого хлеба, то появляется синее окрашивание.
2) Реакция гидролиза:
(С6Н6О5)n + nH2O → nC6H12O6
Получение крахмала.
Применение крахмала.
Крахмал является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают действию высокой температуры, т. е. картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и образуются декстрины, растворимые в воде. Декстрины в пищеварительном тракте подвергаются дальнейшему гидролизу до глюкозы, которая усваивается организмом. Избыток глюкозы превращается в гликоген (животный крахмал). Состав гликогена такой же, как у крахмала, но его молекулы более разветвленные. Особенно много гликогена содержится в печени (до 10%). В организме гликоген является резервным веществом, которое превращается в глюкозу по мере ее расходования в клетках.
В промышленности крахмал путем гидролиза превращают в патоку и глюкозу. Для этого его нагревают с разбавленной серной кислотой, избыток которой затем нейтрализуют мелом. Образовавшийся осадок сульфата кальция отфильтровывают, раствор упаривают и выделяют глюкозу. Если гидролиз крахмала не доводить до конца, то образуется смесь декстринов с глюкозой — патока, которую применяют в кондитерской промышленности. Получаемые из крахмала декстрины используются в качестве клея, для загустения красок при нанесении рисунков на ткань.
Крахмал применяется для накрахмаливания белья. Под горячим утюгом происходит частичный гидролиз крахмала и превращение его в декстрины. Последние образуют на ткани плотную пленку, которая придает блеск ткани и предохраняет ее от загрязнения.
Целлюлоза.
Вторым наиболее распространенным в природе полисахаридом является целлюлоза или клетчатка (см. приложение 4).
Основные понятия. Строение молекулы.

.Формула целлюлозы, как и крахмала - (С6Н10О5)n, элементарным звеном этого природного полимера также служат остатки глюкозы. Степень полимеризации у целлюлозы намного больше, чем у крахмала.
Макромолекулы целлюлозы, в отличие от крахмала, состоят из остатков молекул б -глюкозы и имеют только линейное строение. Макромолекулы целлюлозы располагаются в одном направлении и образуют волокна (лен, хлопок, конопля).
Физические свойства.
Чистая целлюлоза — твердое белое вещество, имеющее волокнистую структуру. Она нерастворима в воде и органических растворителях, но хорошо растворяется в аммиачном растворе гидроксида меди (II). Как известно, сладкого вкуса целлюлоза не имеет.
Химические свойства.
1) Горение. Целлюлоза легко горит с образованием углекислого газа и воды.
(С6Н10О5)n + 6nО2 → nСО2 + nН2О + Q
2) Гидролиз. В отличие от крахмала клетчатка гидролизуется с трудом. Только очень длительное кипячение в водных растворах сильных кислот приводит к заметному расщеплению макромолекулы до глюкозы:
(С6Н10О5)n + nH2O → nC6H12O6
3) Образования сложных эфиров. Каждое элементарное звено молекулы целлюлозы имеет три гидроксильные группы, которые могут участвовать в образовании сложных эфиров как с органическими, и с неорганическими кислотами.
Нитраты целлюлозы. При обработке целлюлозы смесью концентрированных азотной и серной кислот (нитрующая смесь) образуются нитраты целлюлозы. В зависимости от условий проведении реакции и соотношения реагирующих веществ можно получить продукт по двум (динитрат) или трем (тринитрат) гидроксильным группам
Получение целлюлозы.
Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитным. По этому методу, измельченную древесину в присутствии раствора гидросульфита кальция или гидросульфита натрия нагревают в автоклавах при давлении 0,5-0,6 МПа и температуре 150 °С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Применение целлюлозы.
Целлюлоза используется человеком с очень древних времен. Ее применение весьма разнообразно. Из целлюлозы изготавливают многочисленные искусственные волокна, полимерные пленки, пластмассы, бездымный порох, лаки. Большое количество целлюлозы идет на производство бумаги. Большое значение имеют продукты этерификации целлюлозы. Так, например, из ацетилцеллюлозы получают ацетатный шелк. Для этого триацетилцеллюлозу растворяют в смеси дихлорметана и этанола. Образовавшийся вязкий раствор продавливают через фильеры — металлические колпачки с многочисленными отверстиями. Тонкие струи раствора опускаются в шахту, через которую противотоком проходит нагретый воздух. В результате растворитель испаряется и триацетилцеллюлоза выделяется в виде длинных нитей, из которых прядением изготовляют ацетатный шелк.Ацетилцеллюлоза идет также на производство негорючей пленки и органического стекла, пропускающего ультрафиолетовые лучи.
Тринитроцеллюлоза (пироксилин) используется как взрывчатое вещество и для производства бездымного пороха. Для этого тринитроцеллюлозу растворяют в этил-ацетате или в ацетоне. После испарения растворителей компактную массу размельчают и получают бездымный порох. Исторически это был первый полимер, из которого была изготовлена промышленная пластмасса — целлулоид. Ранее пироксилин использовался для изготовления кино- и фотопленки и лаков. Его главный недостаток — легкая горючесть с образованием токсичных оксидов азота.
Динитроцеллюлоза (коллоксилин) применяется также для получения коллодия. В этих целях ее растворяют в смеси спирта и эфира. После испарения растворителей образуется плотная пленка — коллодий, применяемый в медицине. Динитроцеллюлоза идет также на производство пластмассы целлулоида. Его получают путем сплавления ди-нитроцеллюлозы с камфорой.
Приложения.
Приложение 1:
 Приложение 2:
Приложение 2:
I.Моносахариды.
Из шестиуглеродных моносахаридов – гексоз – важное значение имеют глюкоза, фруктоза и галактоза.
Глюкоза.
Основные понятия. Строение молекулы.
Для установления структурной формулы молекулы глюкозы необходимо знать её химические свойства. Экспериментально доказали, что один моль глюкозы реагирует с пятью молями уксусной кислоты с образованием сложного эфира. Это означает, что в молекуле глюкозы имеется пять гидроксильных групп. Так как глюкоза в аммиачном растворе оксида серебра (II) дает реакцию «серебрянного зеркала», то в её молекуле должна быть альдегидная группа.
Опытным путем так же одказали, что глюкоза имеет неразветвленную углеродную цепь. На основании этих данных строение молекулы глюкозы можно выразить следующей формулой:

Как видно из формулы, глюкоза является одновременно многоатомным спиртом а альдегидом, т.е альдегидоспиртом.
Дальнейшие исследование показали, что кроме молекул с открытой цепью, для глюкозы характерны молекулы циклического строения. Это объясняется тем, что молекулы глюкозы, вследствие вращения атомов углерода вокруг связей могут принимать изогнутую форму и гидроксильная группа 5 углерода может приблизиться к гидроксильной группе. В последней под действием гидроксильной группы разрывается π-связь. К свободной связи присоединяется атом водорода, и образуется шестичленное кольцо, в котором альдегидная группа отсутствует. Доказано, что в водном растворе существуют обе формы молекул глюкозы – альдегидная и циклическая, между которыми устанавливается химическое равновесие:

В молекулах глюкозы с открытой цепью альдегидная группа может свободно вращаться вокруг σ-связи, которая находится между первым и вторым атомами углерода. В молекулах циклической формы такое вращение не возможно. По этой причине циклическая форма молекулы может иметь различное пространственное строение:
a) α-форма глюкозы - гидроксильные группы (-ОН) при первом и втором атомах углерода расположены по одну сторону кольца.

b) б - форма глюкозы - гидроксильные группы находятся по разные стороны кольца молекулы.

Физические свойства.
Глюкоза - бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора кристаллизуется. По сравнению со свекловичным сахаром менее сладкая.
Химические свойства.
Глюкоза обладает химическими свойствами, характерными для спиртов (гидроксильная (-ОН) группа) и альдегидов (группа альдегида (-СНО). Кроме того, она обладает и некоторыми специфическими свойствами.
1. Свойства, характерные для спиртов:
а) взаимодействие с оксидом меди (II):
C6H12O6 + Cu(OH)2 → C6H10O6Cu + H2O
алкоголят меди (II)
б) взаимодействие с карбоновыми кислотами с образованием сложных эфиров (реакция этерификации).
C6H12O6+5CH3COOH→C6H7O6(CH3CO)5
Свойства, характерные для альдегидов
а) взаимодействие с оксидом серебра (I) в аммиачном растворе (реакция "серебряного зеркала"):
C6H12O6 + Аg2O → C6H12O7 +2Ag↓
глюкоза глюконовая кислота
б)восстановление (гидрирование) - до шестиатомного спирта (сорбита):
C6H12O6 + H2 → C6H14O6
глюкоза сорбит
3. Специфические реакции - брожение:
а) спиртовое брожение (под действием дрожжей):
С6Н12О6 → 2С2Н5ОН + 2СО2
глюкоза этиловый спирт
б) молочнокислые брожение (под действие молочнокислых бактерий):
С6Н12О6 → С3Н6О3
глюкоза молочная кислота
в) маслянокислое брожение:
С6Н12О6 → С3Н7СООН +2Н2 +2СО2
глюкоза масляная кислота
Получение глюкозы.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А.М.Бутлеровым в 1861 году:
са(он)2
6НСОН → С6Н12О6
формальдегид люкоза
На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
Н2SО4
(С6Н10О5)n + nН2О → nC6H12O6
крахмал глюкоза
Применение глюкозы.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям, в результате которых освобождается энергия, которая накопилась в процессе фотосинтеза. Упрощено процесс окисления глюкозы в организме можно выразить следующим уравнением:
С6Н12О6 + 6О2→6СО2+6H2O+Q
Так как глюкоза легко усваивается организмом, ее используют в медицине в качестве укрепляющего лечебного средства. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников).
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же, как при силосований кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.










 Приложение 2:
Приложение 2:


