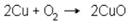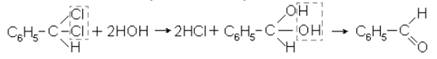Реакции замещения в бензольном кольце протекают легче, чем у бензола, и в более мягких условиях.
1. Галогенирование:

Особенно легко происходит бромирование в водных растворах, при этом сразу образуется 2,4,6-трибромфенол:

2. Нитрование:

3. Сульфирование:
Соотношение орто - и пара -изомеров определяется температурой реакции: при комнатной температуре в основном образуется орто -фенолсульфокислота, при t = 100 ºC – пара -изомер.

III. Реакции присоединения
Гидрирование:

Способы получения
1. Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:

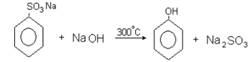
2. Сплавление солей аренсульфокислот со щелочью:
3. Взаимодействием галогенопроизводных ароматических углеводородов со щелочами:

или с водяным паром:

4. Кумольный способ:
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:

В результате этих процессов получают два ценных продукта – фенол и ацетон.
Применение фенола
Схема применения фенола представлена на рис. 2.

ГЛАВА 13. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Органические соединения, в молекуле которых имеется карбонильная группа 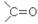 , называют карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы – альдегиды и кетоны. В молекулах альдегидов карбонильная
, называют карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы – альдегиды и кетоны. В молекулах альдегидов карбонильная
группа связана с атомами водорода или с одним углеводородным радикалом:

а в молекулах кетонов – с двумя углеводородными радикалами:

Углеводородные радикалы могут быть алифатическими (насыщенными или ненасыщенными), алициклическими и ароматическими.
Мы рассмотрим только алифатические карбонильные соединения.
АЛЬДЕГИДЫ
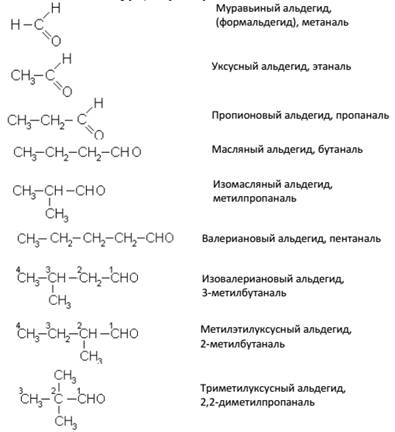
Изомерия. Номенклатура
Общая формула предельных альдегидов CnH2nO или CnH2n+1–CHO. Изомерия альдегидов связана только со строением углеродного скелета и с положением карбонильной группы, например:

Альдегиды называют или по кислотам, в которые они переходят при окислении (с тем же числом углеродных атомов) или по предельным углеводородам с добавлением окончания –аль (систематическая номенклатура). Примеры:
Способы получения
1. Окисление первичных спиртов – важнейший способ получения альдегидов:
а) окисление спирта дихроматом калия применяется преимущественно в лабораторных условиях:

б) окисление спирта кислородом воздуха в присутствии металлических катализаторов.
В качестве катализатора в промышленности используется мелко раздробленная медь. При нагревании медь окисляется кислородом воздуха в окись меди:
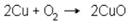
Через систему пропускают пары метилового спирта, смешанные с воздухом.
Метиловый спирт окисляется окисью меди, а образующаяся металлическая медь вновь окисляется кислородом воздуха. Таким образом, эти реакции повторяются неограниченное число раз.

Реакция окисления метилового спирта окисью меди является экзотермической, поэтому нагревание нужно только в начале реакции. Этот способ лежит в основе технического получения некоторых альдегидов.
2. Из дигалогенопроизводных, имеющих оба галогена у одного и того же первичного атома углерода, альдегиды получаются в результате реакции нуклеофильного замещения галогенов на гидроксилы:

Этот способ используется для получения бензойного альдегида:
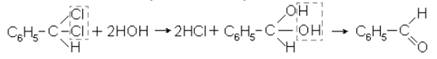
Физические свойства
Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомов водорода с положительным зарядом. По этой причине температура кипения альдегидов значительно ниже, чем соответствующих спиртов. Низшие альдегиды – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде.
Химические свойства
Альдегиды вступают в очень большое число реакций, представляя собой одну из наиболее реакционноспособных групп соединений. Для удобства рассмотрения реакций альдегидов их можно разделить на группы в соответствии с теми атомами и группами атомов, которые присутствуют в молекуле альдегида:

I – атом водорода альдегидной группы, находящийся в непосредственном соседстве с карбонилом и потому обусловливающий легкую способность окисляться;
II – карбонильная группа, которая обусловливает большой ряд реакций присоединения к карбонилу и замещения атома кислорода карбонила;
III – радикал, который может участвовать в ряде реакций, свойственных остаткам углеводородов.
Таким образом, для альдегидов характерны реакции окисления, присоединения, полимеризации и поликонденсации.
I. Реакции окисления
Альдегиды очень легко окисляются. Особенно характерно для альдегидов то, что такие слабые окислители, как некоторые окиси и гидроокиси тяжелых металлов, которые не действуют на ряд других органических соединений, легко окисляют альдегиды с выделением свободных металлов или их закисей (“альдегидные реакции”).














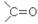 , называют карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы – альдегиды и кетоны. В молекулах альдегидов карбонильная
, называют карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы – альдегиды и кетоны. В молекулах альдегидов карбонильная