Моногалогенопроизводные предельных углеводородов
Моногалогенопроизводные предельных углеводородов носят название галогеналкилов, их общая формула CnH2n+1Hal.
В зависимости от положения атома галогена, характера атома углерода, с которым атомы галогена связаны, различают первичные: R–CH2–Cl; вторичные: R2–CH–Cl; третичные: R3C–Cl – галогеналкилы.
Изомерия. Номенклатура
Изомерия галогенопроизводных зависит от строения углеродного скелета и положения атома галогена в цепи. Следовательно, галогенопроизводные имеют большее число изомеров, чем предельные углеводороды. Изомерия начинается с третьего члена ряда.
Названия галогенопроизводных строятся из названий соответствующих им предельных углеводородов с добавлением названия галогена с цифрой, указывающей его положение в цепи.
Простейшие галогенопроизводные называют по названиям входящих в них радикалов:
CH3–Cl хлорметан, хлористый метил
CH3–CH2Cl хлорэтан, хлористый этил
CH3–CH2–CH2Cl 1 -хлорпропан, хлористый пропил
CH3–CHCl–CH3 2-хлорпропан, хлористый изопропил или хлористый вторичный пропил
CH3–CH2–CH2–CH2–Cl 1-хлорбутан, хлористый бутил
CH3–CHCl–CH2–CH3 2-хлорбутан, хлористый вторичный бутил
CH3–CH(CH3)–CH2Cl 1-хлор-2-метилпропан, хлористый изобутил
 2-хлор-2-метилпропан, хлористый третичный бутил
2-хлор-2-метилпропан, хлористый третичный бутил
Способы получения
Моногалогенопроизводные получают наиболее часто из предельных углеводородов реакцией замещения, из олефинов – присоединением галогеноводородов, из спиртов – реакцией с галогеноводородами фосфора.
1. Получение моногалогенопроизводных из предельных углеводородов реакцией замещения атомов водорода галогенами – наиболее важный технический метод.
Особенности реакции замещения водорода атомами галогена были подробно рассмотрены при изучении химических свойств предельных углеводородов:

Следует отметить, что в органической химии ярко выражена взаимосвязь различных ее разделов. Одни и те же реакции на протяжении всего курса приводятся в одних случаях как характеризующие свойства данного класса соединений, а в других – как метод получения другого класса веществ.
2. Присоединение галогенопроизводных к олефинам (алкенам). Опять мы возвращаемся к свойствам, в этот раз олефинов и вспоминаем правило В. В. Марковникова. «При присоединении галогеноводородов к несимметричным олефинам водород присоединяется к более гидрогенизированному атому углерода, а галоген – к другому, связанному с первым двойной связью, т. е. менее гидрогенизированному.»

3. Замещение гидроксильной группы спиртов на галоген действием галогеноводородов:

Физические свойства
Физические свойства галогенопроизводных зависят от природы атомов галогена, состава и строения углеводородного радикала.
При обычных условиях фтористые метил, этил, пропил и бутил, хлористые метил и этил, бромистый метил являются газами. Все остальные галогеналкилы – жидкости, высшие представители – твердые вещества.
Химические свойства
1. Получение предельных углеводородов из галогенопроизводных путем замены галогена (при действии металлического натрия радикалом, реакция Вюрца):

2. При каталитическом гидрировании галогеноалкинов или действии на них водорода в момент выделения, а также иодистого водорода происходит замещение атома галогена водородом:

3. Гидролиз. При действии воды на галоидные алкилы образуются спирты:

4. Реакции с едкими щелочами можно представить как реакции обмена:

5. Действием аммиака (аммонолиз) можно получить амины:

6. Действием азотистокислого серебра получают нитросоединения:

7. Действием цианидов получают нитрилы или изонитрилы:
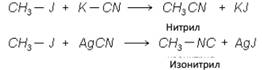
8. Получение сложных эфиров.
С серебряными или иными солями кислот получаются сложные эфиры:

9. При действии металлов (Zn, Mg) получаются металлоорганические соединения.
Особый интерес представляет действие магния на галогеноводороды в присутствии безводного диэтилового эфира с получением растворов, содержащих смешанные магнийорганические соединения – Гриньяровские реактивы.

Такие растворы применяются для многих синтезов. Например:

Изомерия. Номенклатура
Галогенопроизводные с атомами галогена у одного и того же атома углерода называются гименальными, у рядом стоящих атомов углерода – вицинальными.
| CH2Cl2
| дихлорметан, хлористый метилен
|
| CHCl3
| трихлорметан, хлороформ
|
| CCl4
| тетрахлорметан, четыреххлористый углерод
|
| CH3 – CHCl2
| 1, 1-дихлорэтан, этилиден*
|
| CH2Cl – CH2Cl
| 1, 2-дихлорэтан, хлористый этилен
|
* Названия двухвалентных радикалов, имеющих две свободные валентности у одного и того же углеродного атома, производятся заменой окончания –ан предельного углеводорода на -иден (кроме метилена)
| CHCl2 – CH2Cl
| 1, 1, 2-трихлорэтан
|
| CCl3 – CH3
| 1, 1, 1-трихлорэтан
|
| CCl3 – CH2Cl
| 1, 1, 1, 2-тетрахлорэтан
|
| CHCl2 – CHCl2
| 1, 1, 2, 2-тетрахлорэтан
|
| CCl3 – CHCl2
| 1, 1, 1, 2, 2-пентахлорэтан
|
Способы получения
1. Полигалогенопроизводные обычно получают из углеводородов или из кислородосодержащих соединений:

2. Гименальные дигалогенопроизводные образуются при действии пентагалоидов фосфора (пятигалоидных соединений фосфора) на альдегиды и кетоны:

3. Вицинальные дигалогенопроизводные получают присоединением галогенов к непредельным углеводородам:
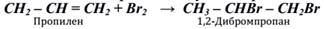
Физические свойства
Ди- и полигалогенопроизводные предельных углеводородов – тяжелые масла или твердые вещества, нерастворимые в воде.
Химические свойства
1. Если атомы галогена находятся при различных атомах углерода, то при гидролизе образуются двухатомные спирты (гликоли).

2. Если атомы галогена находятся при одном углеродном атоме (геминальные соединения), то при гидролизе образуются альдегиды, кетоны или кислоты. Например:

Способы получения
1. Прямое воздействие галогенов на ароматические углеводороды. Характер продуктов реакции сильно зависит от условий проведения реакции. При низких температурах, в присутствии катализаторов, галоид замещает водородные атомы бензольного ядра. Обычными катализаторами являются: галоидные соединении
металлов, особенности алюминия и железа, иод, галоидная сера. Подбирая условия реакции и катализатор, можно последовательно заменить все водородные атомы бензольного ядра на хлор и бром. Например, в присутствии бромного железа или иода можно легко получить монобромбензол и дибромбензол:
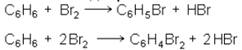
Самыми сильно действующими катализаторами являются галоидные соли алюминия, в присутствии которых на галоид замещаются все водородные атомы бензольного ядра, например:

В гомологах бензола с одной боковой цепью в этих условиях замещаются пять атомов водорода бензольного ядра, например:
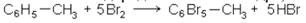
В углеводородах с двумя боковыми цепями замещаются четыре атома водорода, например из ксилолов C6H4(CH3)2 получаются тетрабромксилолы C6Br4(CH3)2.
При действии хлора и брома на гомологи бензола в отсутствии катализатора в газовой фазе при повышенной температуре замещение происходит почти исключительно боковой цепи. Реакция хорошо протекает только на свету (прямые солнечные лучи или яркая лампа). При пропускании хлора в пары кипящего толуола можно последовательно заменить на хлор все три атома водорода метильной группы и получить три соединения:

2. Введение галоида путем замены амигруппы. Этим способом можно синтезировать те изомеры, которые не удается получить путем непосредственного действия галоидов на углеводороды.
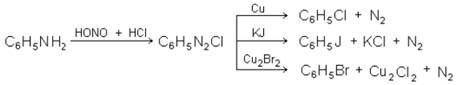
3. Введение галоида в боковую цепь.
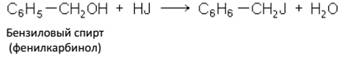
Физические свойства
Галоидные производные ароматических углеводородов представляют собой жидкости или твердые тела с удельным весом больше единицы, нерастворимые в воде, легко растворяющиеся в спирте, эфире и бензоле.
Химические свойства
Соединения, в которых галоид находится в бензольном ядре, по химическим свойствам очень сильно отличаются от соедиБензиловый спирт (фенилкарбинол)
нений, содержащих галоид в боковой цепи. Галоид, находящийся в боковой цепи, обладает не меньшей, а иногда и большей подвижностью, чем в галоидных алкилах, вступая во все свойственные им реакции, например:
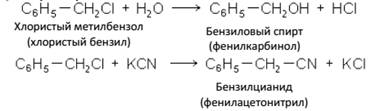
Галоген, состоящий в ядре, например в хлорбензоле C6H5Cl и хлортолуоле C6H4Cl(CH3), связан очень прочно.
Одноатомные спирты

Двухатомные спирты
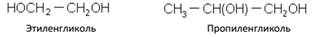
Трехатомные спирты
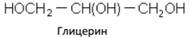
Углеродный атом способен удержать только одну гидроксильную группу; не может гидроксил состоять и при кратной углеродной связи, хотя из этих правил есть исключения.
ОДНОАТОМНЫЕ СПИРТЫ
Изомерия
Изомерия спиртов обусловлена строением радикала (изомерия углеродного скелета) и положением гидроксила в молекуле, в зависимости от того, с каким атомами углерода он связан (с первичным, вторичным или третичным) различают первичные, вторичные и третичные спирты:

Номенклатура
Общая формула гомологического ряда предельных одноатомных спиртов:

Названия спиртов образуют, добавляя окончание – ОЛ к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена радикально – функциональная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с обавлением слова «спирт», например:  – этиловый спирт (этанол).
– этиловый спирт (этанол).
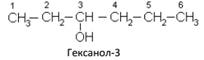
Начиная с третьего представителя гомологического ряда – пропанола, у спиртов появляются изомеры:

В соответствии с международной номенклатурой цифрой после названия спирта обозначают, с каким по счету углеродным атомом связана гидроксильная группа, например:
Получение спиртов
1. Гидратация алкенов
Гидратация алкенов, протекает по правилу Марковникова:

Кроме прямой гидратации этилена (пропилена), существует также сернокислотная гидратация, протекающая в две стадии:
– на первой стадии этилен поглощается серной кислотой:

– на второй стадии этилсерная кислота гидролизуется с образованием этилового спирта и серной кислоты:

При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:

2. Гидролиз галогеноалкинов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой – OH:

Обратите внимание, что при действии спиртового раствора щелочи (KOH, NaOH) происходит отщепление галогеноводорода и образование алкена (см. 3 пункт “получение алкенов”):

3. Гидрирование альдегидов и кетонов
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов и кетонов – является, таким образом, их восстановлением.
В присутствии катализаторов (Ni, Pt, Pd, Co) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов:

4. Специфические способы получения метанола и этанола

Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:

Физические свойства
Рассмотрим электронное строение молекулы спирта:

Молекулы алканов представляют собой диполи. Они содержат полярные связи
C – H, C – O, O – H. Дипольные моменты связей C → O и O ← H направлены в сторону атома кислорода, поэтому атом O имеет частичный отрицательный заряд δ-, а атомы C и H – частичные положительные заряды δ+. Полярность связи О – Н больше полярности связи С – О вследствие большей разности электроотрицательностей кислорода и водорода.
Полярность связи О – Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
В гомологическом ряду спиртов нет газообразных веществ.

Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол, пропанол неограниченно растворяются в воде; с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается; высшие
спирты не растворяются в воде.
Химические свойства
Химические свойства алканов определяются особенностями их электронного строения:

наличием в их молекулах полярных связей О – Н, С – О, С – Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I. Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О – Н:
А. Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов:

Эти реакции протекают только в безводной среде. В присутствии воды алкоголяты полностью гидролизуются:

Б. Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):


Реакции этерификации являются обратимыми реакциями.
2. Замещение гидроксильной группы вследствие разрыва связи С – О:
А. Взаимодействие с галогеноводородами с образованием галогеналканов:

Спирты можно превратить в галогенпроизводные действием и других реагентов, например хлоридов фосфора:

Б. Взаимодействие с аммиаком с образованием аминов.
Реакции идут при пропускании смеси паров спирта с аммиаком при 300 °С над оксидом алюминия:

При избытке спирта алкильным радикалом могут замещаться 2 или 3 атома водорода в молекуле NH3:

II. Реакции отщепления
1. Дегидратация, т. е. отщепление воды Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
А. Межмолекулярная дегидратация спиртов с образованием простых эфиров R – O – R'.
Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:

Б. Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:

Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева: «При образовании воды наиболее легко отщепляется водород от соседнего наименее гидрогенизированного атома углерода»

2. Дегидрирование (разрыв связей О – Н и С – Н):
А. При дегидрировании первичных спиртов образуются альдегиды:

В организме человека этот процесс происходит под действием фермента алкогольдегидрогенозы.
Б. При дегидрировании вторичных спиртов образуются кетоны:
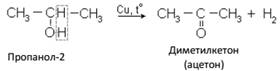
В. Третичные спирты не дегидрируются.
III. Реакция окисления
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла:

2. Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:

Таким образом, реакции дегидрирования спиртов по своей химической сущности являются реакциями окисления.
Глицерин
Простейший представитель трехатомных предельных спиртов – глицеринов. Это бесцветная, вязкая, гигроскопичная жидкость, сладкая на вкус. Смешивается с водой в любых отношениях. Хорошо растворяет многие вещества.
По химическим свойствам близок к этиленгликолю. Большое значение имеет реакция взаимодействия глицерина с азотной кислотой с образованием нитроглицерина:

Нитроглицерин – исторически сложившееся название – неточно: у нитросоединений, нитрогруппа непосредственно присоединена к углеродному атому. Правильнее его было бы отнести к эфирам. Нитроглицерин – эфир глицерина и азотной кислоты – тринитрат глицерина.
Нитроглицерин – тяжелая маслянистая жидкость, взрывчатое вещество (взрывается от легкого сотрясения и нагревания).
Получают глицерин из жиров, а также синтетическим путем – из газов крекинга нефти (пропилена), т. е. из непищевого сырья.

Глицерин применяется для производства нитроглицерина, приготовления антифризов, в косметике (смягчает кожу), в кожевенной промышленности. Однопроцентный спиртовой раствор нитроглицерина используется как лекарство при сердечных заболеваниях (расширяет кровеносные сосуды).
ФЕНОЛЫ
Фенолы – это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца (рис. 1).

Номенклатура. Изомерия
Возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи.
Многие фенолы имеют тривиальные названия.
Физические свойства
Фенолы – бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом, трудно растворимые в воде, токсичны, являются антисептиками. При попадании на кожу вызывают ожоги.
Фенол –  (карболовая кислота) – бесцветное кристаллическое вещество, tплав = 43 ºС, tкип = 182 ºС, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 ºС смешивается с водой в любых соотношениях. Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
(карболовая кислота) – бесцветное кристаллическое вещество, tплав = 43 ºС, tкип = 182 ºС, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 ºС смешивается с водой в любых соотношениях. Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы – ОН и бензольного кольца.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Бензол диссоциирует по схеме:

Кислотные свойства
1) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):

2) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами):

Образующиеся в результате реакции 1) и 2) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов (следовательно, фенол – еще более слабая кислота, чем угольная).
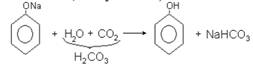
Феноляты используют в качестве исходных веществ для получения простых и сложных эфиров фенола:

III. Реакции присоединения
Гидрирование:

Способы получения
1. Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:

2. Сплавление солей аренсульфокислот со щелочью:
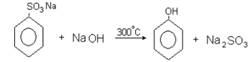
3. Взаимодействием галогенопроизводных ароматических углеводородов со щелочами:

или с водяным паром:

4. Кумольный способ:
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:

В результате этих процессов получают два ценных продукта – фенол и ацетон.
Применение фенола
Схема применения фенола представлена на рис. 2.

АЛЬДЕГИДЫ
Изомерия. Номенклатура
Общая формула предельных альдегидов CnH2nO или CnH2n+1–CHO. Изомерия альдегидов связана только со строением углеродного скелета и с положением карбонильной группы, например:

Альдегиды называют или по кислотам, в которые они переходят при окислении (с тем же числом углеродных атомов) или по предельным углеводородам с добавлением окончания –аль (систематическая номенклатура). Примеры:
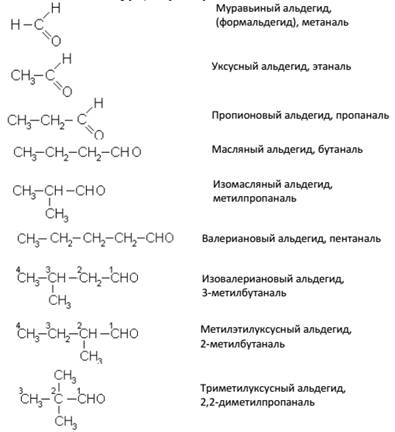
Способы получения
1. Окисление первичных спиртов – важнейший способ получения альдегидов:
а) окисление спирта дихроматом калия применяется преимущественно в лабораторных условиях:

б) окисление спирта кислородом воздуха в присутствии металлических катализаторов.
В качестве катализатора в промышленности используется мелко раздробленная медь. При нагревании медь окисляется кислородом воздуха в окись меди:
Через систему пропускают пары метилового спирта, смешанные с воздухом.
Метиловый спирт окисляется окисью меди, а образующаяся металлическая медь вновь окисляется кислородом воздуха. Таким образом, эти реакции повторяются неограниченное число раз.

Реакция окисления метилового спирта окисью меди является экзотермической, поэтому нагревание нужно только в начале реакции. Этот способ лежит в основе технического получения некоторых альдегидов.
2. Из дигалогенопроизводных, имеющих оба галогена у одного и того же первичного атома углерода, альдегиды получаются в результате реакции нуклеофильного замещения галогенов на гидроксилы:

Этот способ используется для получения бензойного альдегида:
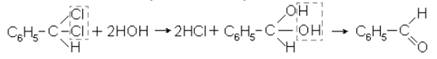
Физические свойства
Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомов водорода с положительным зарядом. По этой причине температура кипения альдегидов значительно ниже, чем соответствующих спиртов. Низшие альдегиды – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде.
Химические свойства
Альдегиды вступают в очень большое число реакций, представляя собой одну из наиболее реакционноспособных групп соединений. Для удобства рассмотрения реакций альдегидов их можно разделить на группы в соответствии с теми атомами и группами атомов, которые присутствуют в молекуле альдегида:

I – атом водорода альдегидной группы, находящийся в непосредственном соседстве с карбонилом и потому обусловливающий легкую способность окисляться;
II – карбонильная группа, которая обусловливает большой ряд реакций присоединения к карбонилу и замещения атома кислорода карбонила;
III – радикал, который может участвовать в ряде реакций, свойственных остаткам углеводородов.
Таким образом, для альдегидов характерны реакции окисления, присоединения, полимеризации и поликонденсации.
I. Реакции окисления
Альдегиды очень легко окисляются. Особенно характерно для альдегидов то, что такие слабые окислители, как некоторые окиси и гидроокиси тяжелых металлов, которые не действуют на ряд других органических соединений, легко окисляют альдегиды с выделением свободных металлов или их закисей (“альдегидные реакции”).
Окисление гидроокисью меди
Если к жидкости со светло-голубым осадком гидроокиси меди (II) прибавить раствор, содержащий альдегид, и нагреть смесь, то вместо голубого осадка появляется желтый осадок гидроокиси меди (I) CuOH. Альдегид при этом превращается в кислоту:

3. Кислородом воздуха окисляются некоторые наиболее легко окисляющиеся альдегиды, к которым относятся ароматические альдегиды, как, например, бензальдегид:

*Аммиак образует с ионом серебра комплексное соединение, что приводит к
образованию хорошо растворимого соединения:

4. Реакция Канниццаро или реакция дисмутации является реакцией окисления – восстановления, при которой из двух молекул альдегида одна окисляется в кислоту, а другая при этом восстанавливается в спирт. Эта реакция, свойственная преимущественно ароматическим альдегидам, была открыта в 1853 г. итальянским ученым Канниццаро, который установил, что в присутствии Бензойная кислота концентрированного раствора щелочи (например, 60%-го раствора КОН) бензальдегид превращается в соль бензойной кислоты и бензиловый спирт:

Из алифатических альдегидов в реакцию Канниццаро вступают формальдегид и альдегиды, содержащие альдегидную группу у четвертичного атома углерода:

II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида
происходит образование полимера с n = 8–100 – параформальдегида:

Полимеризация безводного формальдегида в присутствии катализатора – пентакарбоната железа Fe(CO)5 – приводит к образованию высокомолекулярного соединения с n = 8÷100 – полиформальдегида (полиоксиметилен, полиметиленоксид):

IV. Реакции поликонденсации
Реакции поликонденсации – это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как H2O, HCl, NH3 и т. д.
В кислой или щелочной среде при нагревании формальдегид образует с фенолом высокомолекулярные продукты – фенолоформальдегидные смолы различного строения:

Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта:
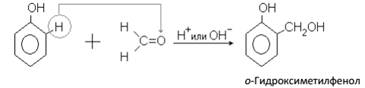
При нагревании фенолоспирты конденсируются с образованием фенолоформальдегидных полимеров:

Фенолоформальдегидные смолы используются для получения пластических масс (фенопластов).
КЕТОНЫ
Общая формула предельных кетонов CnH2nO или CnH2n+1–CO–CnH2n+1.
Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи. Кетоны называют по наименованию радикалов, связанных с карбонильной группой, или по систематической номенклатуре: к названию предельного углеводорода добавляется окончание - OH и указывается номер атома углерода, связанного с карбонильным кислородом:


Физические свойства
Простейший кетон – ацетон – жидкость. Последующие представители также являются жидкостями. Высшие алифатические, а также ароматические кетоны – твердые вещества. Простейшие кетоны смешиваются с водой. Все кетоны хорошо растворимы в
спирте и эфире. Простейшие кетоны обладают характерным запахом; средние гомологи имеют приятный запах, напоминающий запах мяты. Температура кипения возрастает по мере увеличения молекулярного веса.
Химические свойства
Кетоны, как и альдегиды отличаются большой реакционной способностью. Большинство их реакций обусловлено присутствием активной карбонильной группы. В то же время кетоны не имеют характерного для альдегидов водородного атома, связанного с карбонилом, и поэтому не дают целого ряда окислительных реакций, очень характерных для альдегидов. В общем кетоны представляют собой вещества менее реакционноспособные, чем альдегиды.
Способы получения
Кетоны можно получить способами, аналогичными тем, которыми получают альдегиды.
1. Окисление вторичных спиртов:

2. Получение из дигалогенопроизводных, у которых оба атома галогена находятся у одного и того же вторичного атома углерода:

3. Получение из кальциевых солей карбоновых кислот путем их сухой перегонки. Из ацетата кальция получается ацетон:
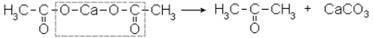
Для получения смешанных кетонов (с разными радикалами) берут соли соответствующих кислот, содержащих нужные радикалы.
4. При сухой перегонке дерева получаются некоторые кетоны, например ацетон и метилэтилкетон.
5. Ароматические кетоны удобно получать реакцией Фриделя-Крафтса, действуя на хлорангидрид жирной (а) или ароматической (б) кислоты, ароматическим углеводородом в присутствии хлорида алюминия:

Строение. Номенклатура
Карбоновыми кислотами называются производные углеводородов, молекулы которых содержат одну или несколько карбоксильных групп:

Эта сложная группа состоит из двух простых групп: карбонильной = С = О и гидроксидной – ОН. Водород карбоксильной группы обуславливает кислые свойства, а количество карбоксильных групп в молекуле кислоты определяет ее основность.
Предельные одноосновные кислоты – содержат одну группу – СООН. Они образуют гомологический ряд с общей формулой: CnH2n+1COOH.
Здесь карбоксил соединен с углеводородным радикалом. Простейшим представителем этого ряда является муравьиная кислота  , у которой карбоксил соединен не с углеводородным радикалом, а с атомом водорода.
, у которой карбоксил соединен не с углеводородным радикалом, а с атомом водорода.
Для низших членов ряда карбоновых кислот употребляются тривиальные названия: муравьиная кислота, уксусная, масляная и т. д.
По рациональной номенклатуре пользуются названием, где сложная кислота рассматривается как производное уксусной или другой менее сложной кислоты.
По современным международным правилам название карбоновой кислоты составляется добавлением к названию углеводорода окончания -ОВАЯ и слово «кислота». Углеродный атом карбоксильной группы определяет начало нумерации и входит в счет атомов главной углеродной цепи. В табл. приведены формулы и названия некоторых карбоновых кислот.

Физические свойства
Низшие представители класса алифатических кислот – легкоподвижные жидкости, далее, начиная с валериановой кислоты, идут кислоты, имеющие характер маслянистых жидкостей, высшие – твердые в<



 2-хлор-2-метилпропан, хлористый третичный бутил
2-хлор-2-метилпропан, хлористый третичный бутил














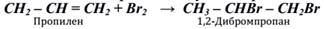




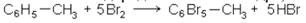


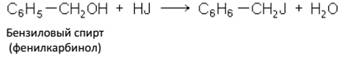


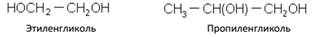
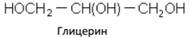


 – этиловый спирт (этанол).
– этиловый спирт (этанол).































 (карболовая кислота) – бесцветное кристаллическое вещество, tплав = 43 ºС, tкип = 182 ºС, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 ºС смешивается с водой в любых соотношениях. Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
(карболовая кислота) – бесцветное кристаллическое вещество, tплав = 43 ºС, tкип = 182 ºС, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 ºС смешивается с водой в любых соотношениях. Фенол – токсичное вещество, вызывает ожоги кожи, является антисептиком.
















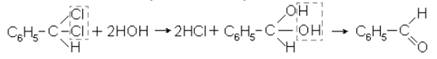















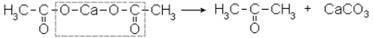


 , у которой карбоксил соединен не с углеводородным радикалом, а с атомом водорода.
, у которой карбоксил соединен не с углеводородным радикалом, а с атомом водорода.



