31-35. Определите тип химической связи в молекуле вещества А, изобразите ее структурную формулу:
| Задачи
|
|
|
|
|
|
| A
| Аl2О3
| СS2
| СBr4
| РН3
| СаF2
|
36-40. Определите число связей и их характер в соединении А:
| Задачи
|
|
|
|
|
|
|
| SiH4
| SiO2
| K2SiF6
| С2Н6
| СCl4
|
41. Как и почему изменяется длина связи в ряду: CF4, CCl4, CBr4?
42. Сколько σ- и π-связей имеется в молекулах С2Н2 и РН3?
43. Составьте электронную формулу хрома, содержащегося в соединении Cr2(SO4)3.
44. Определите тип гибридизации орбиталей атома металла в молекуле хлорида кальция и изобразите геометрическую форму молекулы.
45. Определите тип гибридизации орбиталей атома азота в ионе аммония и изобразите геометрическую форму частицы.
Занятие 4. определение теплового эффекта процессов
Пример выполнения упражнения:
Задача. Вычислить тепловой эффект, написать термохимическое уравнение горения 1 моля метана и рассчитать количество теплоты, которое выделится при сгорании 10 л CH4.
Решение. Составим термохимическое уравнение реакции

Выпишем стандартные теплоты образования  веществ (прил.1):
веществ (прил.1):
 ,
,
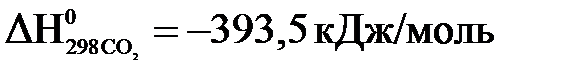 ,
,
 .
.
Тепловой эффект реакции вычислим, используя следствие закона Гесса:
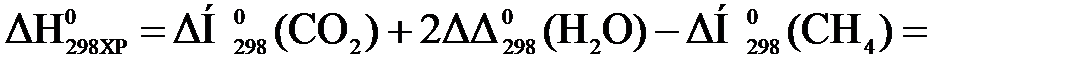

При сжигании 22,4 л выделяется 802,2 кДж, при сжигании 10 л выделяется х кДж. Составим и решим пропорцию:
 .
.
Ответ:  , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж.
Задания для практической работы
46-50. Рассчитайтестандартный тепловой эффект реакции, предварительно подобрав коэффициенты в уравнении, и установите, является ли реакция экзо- или эндотермической. Стандартные энтальпии образования реагентов А, В и продуктов С и D взять из прил.1:
Задачи Реакции
A B C D
46 CuCl2(т) + H2O(г) CuO(т) + HCl(г)
47 Al2(SO4)3(т) Al2O3(т) + SO3(г)
48 CS2(ж) + O2(г) CO2(г) + SO2(г)
49 HF(г) +N2(г) NF3(г) + H2(г)
50Na2SO3(т)Na2SO4(т) + Na2S(т)
51- 55. По термохимическому уравнению взаимодействия реагентов А и В, рассчитайте стандартную энтальпию образования продукта D. Известны (прил. 1) стандартный тепловой эффект химической реакции  Н°х.р. и стандартные энтальпии образования реагентов
Н°х.р. и стандартные энтальпии образования реагентов  :
:
| Задачи
| Реакции
|
|
| А
| В
| С
|
| D
| 
|
|
| Na2O(т)
| + SO3(т)
| + H2O(ж)
|
| NaHSO4(т)
| -650
|
|
| Na2O(т)
| + SO2(г)
| + S(т)
|
| Na2 S2O3(т)
| -402
|
|
| CuO(т)
| + NO2(г)
| + O2(г)
|
| Cu(NO3)2(т)
| -440
|
|
| H2O(г)
| + CO2(г)
| + CuO(т)
|
| Cu2(OH)2CO3(т)
| -101
|
|
| MgO(т)
| + NO2(г)
| + O2(г)
|
| Mg(NO3)2(т)
| -510
|
56-60. Вычислите количество теплоты, выделившееся при сгорании углеродсодержащего топлива А массой m, в котором также содержится негорючий компонент с массовой долей Сm. Считать, что горючим компонентом в топливе является углерод С(т):
| Задачи
|
|
|
|
|
|
| А
| Антрацит
| Бурый уголь
| Каменный уголь
| Горючий сланец
| Кокс
|
| m, кг
|
|
|
|
|
|
| Cm, %
^т. /о
|
|
|
|
|
|
Занятие 5. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Пример решения задачи
Задача. Во сколько раз изменится скорость прямой гомогенной одностадийной реакции А+В=С, если концентрацию вещества А увеличить в два раза, а концентрацию вещества В уменьшить в 4 раза.
Решение. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс.
1. Согласно этому закону для гомогенной реакции А+В=С можно составить кинетическое уравнение: V1=k[A][B].
2. Обозначим концентрацию А через х, концентрацию В через у, тогда кинетическое уравнение реакции можно записать в виде V1=kxy.
3. Определим скорость реакции при увеличении концентрации А в 2 раза и одновременном уменьшении концентрации В в 4 раза:
 .
.
Находим отношение скоростей:  .
.
Таким образом, при изменении концентраций веществ, скорость уменьшается в 2 раза.
Ответ: V2 /V1 = 1/2.
Задания для практических работ
61 – 65 Восколько раз изменится скорость прямой гомогенной реакции, если концентрацию вещества А увеличить в X раз, а концентрацию вещества В уменьшить в Y раз
| Задачи
| Реакция
| X
| Y
|
|
| А+2В=С
|
|
|
|
| 2А+В=С
|
|
|
|
| 3А+2В=С
|
|
|
|
| А+3В=С
|
|
|
|
| А+В=С
|
|
|
66-70. Температурный коэффициент скорости некоторой реакции равен g. Во сколько раз увеличится скорость этой реакции, если температуру повысить на Δt, 0С?
| Задачи
|
|
|
|
|
|
| g
| 2,0
| 2,4
| 2,2
| 3,0
| 3,8
|
| Δt, 0С
|
|
|
|
|
|
71-75. Равновесие в гомогенной газовой системе установилось в момент, когда прореагировало 50% вещества А. Вычислите константу равновесия, если концентрации исходных веществ равны СоА и СоВ. В какую сторону сместится равновесие при повышении давления?
| Задачи
| Система
| СоА,моль/л
| СоВ, моль/л
|
|
| 2А+2В=С+2D
| 1,1
| 2,5
|
|
| А+4В =2С+2D
| 0,8
| 2,6
|
|
| 3А+ В =С+3D
| 1,2
| 0,8
|
|
| 2А+3В=С+3D
| 0,3
| 0,7
|
|
| А +2В =2С+D
| 1,0
| 1,6
|




 веществ (прил.1):
веществ (прил.1): ,
,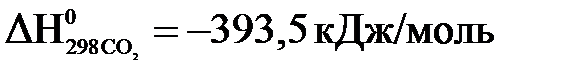 ,
, .
.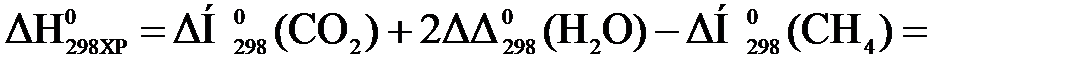

 .
. , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж. Н°х.р. и стандартные энтальпии образования реагентов
Н°х.р. и стандартные энтальпии образования реагентов  :
:
 .
. .
.

