Наряду с массой и объемом в химических расчетах часто используется количество вещества, пропорциональное числу содержащихся в веществе структурных единиц. При этом в каждом случае должно быть указано, какие именно структурные единицы (молекулы, атомы, ионы и т. д.) имеются в виду. Единицей количества вещества является моль.
Моль — количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
Число структурных единиц, содержащихся в 1 моле вещества (постоянная Авогадро) определено с большой точностью; в практических расчетах его принимают равным 6,02 • 1024 моль-1.
Нетрудно показать, что масса 1 моля вещества (мольная масса), - выраженная в граммах, численно равна относительной молекулярной массе этого вещества.
Так, относительная молекулярная масса (или, сокращенно молекулярная масса) свободного хлора С1г равна 70,90. Следовательно, мольная масса молекулярного хлора составляет 70,90 г/моль. Однако мольная масса атомов хлора вдвое меньше (45,45 г/моль), так как 1 моль молекул хлора Сl содержит 2 моля атомов хлора.
Согласно закону Авогадро, в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Иными словами, одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется мольным объемом газа и при нормальных условиях (0°С, давление 101, 425 кПа) равен 22,4 л.
Объемным содержанием газа в газовой смеси называется часть объема газовой смеси, которую занимало бы содержащееся в ней количество данного газа при той же температуре и парциальном давлении, равном общему давлению газовой смеси; эта величина может быть выражена в долях общего объема (объемная доля) или в процентах от общего объема (процент по объему).
Например, утверждение «содержание диоксида углерода в воздухе составляет 0,04% (об.)» означает, что при парциальном давлении СО2, равном давлению воздуха, и при той же температуре диоксид углерода, содержащийся в воздухе, займет 0,04% общего объема, занимаемого воздухом.
Контрольное задание
1. Сопоставить числа молекул, содержащихся в 1 г NH4 и в 1 г N2. В каком случае и во сколько раз число молекул больше?
2. Выразить в граммах массу одной молекулы диоксида серы.
4. Сколько молекул содержится в 5,00 мл хлора при нормальных условиях?
4. Какой объем при нормальных условиях занимают 27 • 1021 молекул газа?
5. Выразить в граммах массу одной молекулы NО2-
6. Каково соотношение объемов, занимаемых 1 молем О2 и 1 молем Оз (условия одинаковые)?
7. Взяты равные массы кислорода, водорода и метана при одинаковых условиях. Найти отношение объемов взятых газов.
8. На вопрос, какой объем займет 1 моль воды при нормальных условиях, получен ответ: 22,4 л. Правильный ли это ответ?
9. Выразить в граммах массу одной молекулы HCl.
Сколько молекул диоксида углерода находится в 1 л воздуха, если объемное содержание СО2 составляет 0,04% (условия нормальные)?
10. Сколько молей содержится в 1 м4 любого газа при нормальных условиях?
11. Выразить в граммах массу одной молекулы Н2О-
12. Сколько молей кислорода находится в 1 л воздуха, если объемное
содержание его составляет 21% (условия нормальные)?
14. Сколько молей азота находится в 1 л воздуха, если объемное содержание его составляет 78% (условия нормальные)?
14. Взяты равные массы кислорода, водорода и азота при одинаковых условиях. Найти отношение объемов взятых газов.
15. Сопоставить числа молекул, содержащихся в 1 г NО2 и в 1 г N2. В каком случае и во сколько раз число молекул больше?
16. Сколько молекул содержится в 2,00 мл водорода при нормальных условиях?
17. Выразить в граммах массу одной молекулы Н2О-
18. Какой объем при нормальных условиях занимают 17 • 1021 молекул газа?
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
При определении понятия скорости химической реакции необходимо различать гомогенные и гетерогенные реакции. Если реакция протекает в гомогенной системе, например, в растворе или в смеси газов, то она идет во всем объеме системы. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы. Поскольку отношение числа молей вещества к объему, в котором оно распределено, есть молярная концентрация вещества, скорость гомогенной реакции можно также определить как изменение концентрации в единицу времени какого-либо из веществ: исходного реагента или продукта реакции. Чтобы результат расчета всегда был положительным, независимо, от того, производится он по реагенту или продукту, в формуле используется знак «±»:

 .
.
В зависимости от характера реакции время может быть выражено не только в секундах, как требует система СИ, но также в минутах или часах. В ходе реакции величина ее скорости не постоянна, а непрерывно изменяется: уменьшается, так как уменьшаются концентрации исходных веществ. Вышеприведенный расчет дает среднее значение скорости реакции за некоторый интервал времени Δτ = τ2 – τ1. Истинная (мгновенная) скорость определяется как предел к которому стремится отношение Δ С / Δτ при Δτ → 0, т. е. истинная скорость равна производной концентрации по времени.
Для реакции, в уравнении которой есть стехиометрические коэффициенты, отличающиеся от единицы, значения скорости, выраженные по разным веществам, неодинаковы. Например для реакции А + 4В = D + 2Е расход вещества А равен одному молю, вещества В – трем молям, приход вещества Е – двум молям. Поэтому υ (А) = ⅓ υ (В) = υ (D) =½ υ (Е) или υ (Е). = ⅔ υ (В).
Если реакция протекает между веществами, находящимися в различных фазах гетерогенной системы, то она может идти только на поверхности раздела этих фаз. Например, взаимодействие раствора кислоты и куска металла происходит только на поверхности металла. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз:
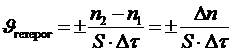
 .
.
Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, равные коэффициентам при формулах этих веществ в уравнении реакции. Тогда для реакции
2А + В → продукты
справедливо соотношение υ ~ · С А2· С В, а для перехода к равенству вводится коэффициент пропорциональности k, называемый константой скорости реакции:
υ = k · С А2· С В = k ·[А]2·[В]
(молярные концентрации в формулах могут обозначаться как буквой С с соответствующим индексом, так и формулой вещества, заключенной в квадратные скобки). Физический смысл константы скорости реакции – скорость реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Размерность константы скорости реакции зависит от числа сомножителей в правой части уравнения и может быть с–1; с–1·(л/моль); с–1·(л2/моль2) и т. п., то есть такой, чтобы в любом случае при вычислениях скорость реакции выражалась в моль·л–1·с–1.
Для гетерогенных реакций в уравнение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, представляет постоянную величину и входит в константу скорости, например, для процесса горения угля С + О2 = СО2 закон действия масс записывается:
υ = kI ·const·[O2]·= k ·[O2],
где k = kI ·const.
В системах, где одно или несколько веществ являются газами, скорость реакции зависит также и от давления. Например, при взаимодействии водорода с парами иода H2 + I2 =2HI скорость химической реакции будет определяться выражением:
υ = k ·[H2]·[I2].
Если увеличить давление, например, в 4 раза, то во столько же раз уменьшится объем, занимаемый системой, и, следовательно, во столько же раз увеличатся концентрации каждого из реагирующих веществ. Скорость реакции в этом случае возрастет в 9 раз
Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2‑4 раза. Это означает, что при повышении температуры в арифметической прогрессии скорость химической реакции возрастает в геометрической прогрессии. Основанием в формуле прогрессии является температурный коэффициент скорости реакции γ, показывающий, во сколько раз увеличивается скорость данной реакции (или, что то же самое – константа скорости) при росте температуры на 10 градусов. Математически правило Вант-Гоффа выражается формулами:
 или
или 
где  и
и  – скорости реакции соответственно при начальной t 1 и конечной t 2 температурах. Правило Вант-Гоффа может быть также выражено следующими соотношениями:
– скорости реакции соответственно при начальной t 1 и конечной t 2 температурах. Правило Вант-Гоффа может быть также выражено следующими соотношениями:
 ;
;  ;
;  ;
; 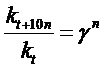 ,
,
где  и
и  – соответственно скорость и константа скорости реакции при температуре t;
– соответственно скорость и константа скорости реакции при температуре t;  и
и  – те же величины при температуре t +10 n; n – число «десятиградусных» интервалов (n =(t 2– t 1)/10), на которые изменилась температура (может быть числом целым или дробным, положительным или отрицательным).
– те же величины при температуре t +10 n; n – число «десятиградусных» интервалов (n =(t 2– t 1)/10), на которые изменилась температура (может быть числом целым или дробным, положительным или отрицательным).
Контрольное задание
1. Найти значение константы скорости реакции А + В —> АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5 • 10-5 моль/(л-мин).
2. Во сколько раз изменится скорость реакции 2А + В —> А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
4. Во сколько раз следует увеличить концентрацию вещества, В2 в системе 2А2 (г.) + В2 (г.) = 2А2В(г.), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
4. Через некоторое время после начала реакции ЗА+В—>2C+D концентрации веществ составляли: [А] =0,04 моль/л; [В] = 0,01 моль/л; [С] =0,008 моль/л. Каковы исходные концентрации веществ А и В?
5. В системе СО + С12 = СОС12 концентрацию увеличили от 0,04 до 0,12 моль/л, а концентрацию хлора — от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
6. Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,04 моль/л, [В]о = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
7. Как изменится скорость реакции 2СO + О2 = 2СО2, протекающей в закрытом сосуде, если увеличить давление в 2 раза?
8. Вычислить, во сколько раз увеличится скорость реакции, если повысить температуру системы от 20 °С до 100 °С, приняв значение температурного коэффициента скорости реакции равным 4.
9. Как изменится скорость реакции 2NO(r.) + 02 (г.) → 2N02(r.), если увеличить давление в системе в 4 раза;
10. Как изменится скорость реакции 2NO(r.) + 02 (г.) → 2N02(r.), если уменьшить объем системы в 4 раза?
11. Как изменится скорость реакции 2NO(r.) + 02 (г.) → 2N02(r.), если повысить концентрацию NO в 4 раза?
12. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 40 градусов скорость реакции
возрастает в 15,6 раза?
14.. Найти значение константы скорости реакции А + В —> АВ, если при концентрациях веществ А и В, равных соответственно 0,07 и 0,09 моль/л, скорость реакции равна 2,7 • 10-5 моль/(л-мин).
14. Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,01 моль/л, [В]о = 0,04 моль/л. Константа скорости реакции равна 0,5. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
15. Как изменится скорость реакции 2NO(r.) + 02 (г.) → 2N02(r.), если увеличить давление в системе в 2 раза;
16. В системе СО + С12 = СОС12 концентрацию увеличили от 0,05 до 0,1 моль/л, а концентрацию хлора — от 0,04 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
17. Вычислить, во сколько раз увеличится скорость реакции, если повысить температуру системы от 20 °С до 80 °С, приняв значение температурного коэффициента скорости реакции равным 2.
18. Вычислить, во сколько раз увеличится скорость реакции, если повысить температуру системы от 40 °С до 90 °С, приняв значение температурного коэффициента скорости реакции равным 4.
ХИМИЧЕСКАЯ СВЯЗЬ. ОБРАЗОВАНИЕ Й СТРУКТУРА МОЛЕКУЛ
1.Какие типы химической связи Вам известны? Приведите пример образования ионной связи по методу валентных связей.
2. Какую химическую связь называют ковалентной? Что характерно для ковалентного типа связи?
4. Какими свойствами характеризуется ковалентная связь? Покажите это на конкретных примерах.
4. Какой тип химической связи в молекулах Н2; Cl2 НС1?
5.Какой характер имеют связи в молекулах NCI4, CS2, СО2? Укажите для каждой нз них направление смещения общей электронной пары.
6. Какую химическую связь называют ионной? Что характерно для ионного типа связи?
7. Какой тип связи в молекулах NaCl, N2, Cl2?
8. Изобразите все возможные способы перекрывания s-орбитали с р-орбиталью;. Укажите направленность связи при этом.
9. Объясните донорно-акцепторный механизм ковалентной связи на примере образования иона фосфония [РН4]+.
10.В молекулах СО, С02, связь полярная или неполярная? Объясните. Опишите водородную связь.
11. Почему некоторые молекулы, имеющие полярные связи, в целом являются неполярными?
12.Ковалентный или ионный тип связи характерен для следующих соединений: Nal, S02, KF? Почему ионная связь является предельным случаем ковалентной?
14. Что такое металлическая связь? Чем она отличается от ковалентной связи? Какие свойства металлов она обусловливает?
14. Каков характер связей между атомами в молекулах; KHF2, Н20, HNO?
15. Чем объяснить высокую прочность связи между атомами в молекуле азота N2 и значительно меньшую в молекуле фосфора Р4?
16. Какую связь называют водородной? Почему для молекул H2S и НС1 в отличие от Н2О и HF образование водородных связей не характерно?
17. Какую связь называют ионной? Обладает ли ионная связь свойствами насыщаемости и направленности? Почему она является предельным случаем ковалентной связи?
18. Какой тип связи в молекулах NaCl, N2, Cl2?




 .
.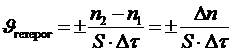
 .
. или
или 
 и
и  – скорости реакции соответственно при начальной t 1 и конечной t 2 температурах. Правило Вант-Гоффа может быть также выражено следующими соотношениями:
– скорости реакции соответственно при начальной t 1 и конечной t 2 температурах. Правило Вант-Гоффа может быть также выражено следующими соотношениями: ;
;  ;
;  ;
; 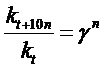 ,
, и
и  – соответственно скорость и константа скорости реакции при температуре t;
– соответственно скорость и константа скорости реакции при температуре t;  и
и  – те же величины при температуре t +10 n; n – число «десятиградусных» интервалов (n =(t 2– t 1)/10), на которые изменилась температура (может быть числом целым или дробным, положительным или отрицательным).
– те же величины при температуре t +10 n; n – число «десятиградусных» интервалов (n =(t 2– t 1)/10), на которые изменилась температура (может быть числом целым или дробным, положительным или отрицательным).


