

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
Задача 1.
Определите стандартное изменение энтальпии ∆ Н 0хр реакции окисления метана.
РЕШЕНИЕ. Запишем термохимическое уравнения реакции окисления метана и выпишем табличные значения стандартных энтальпий образования веществ:
СН4 (г.) + 202 (г.) = С02(г.) + 2Н2О(г.)
∆ Н °298, кДж/моль -74,9 0 -393,5 -241,8
В соответствии с 1 следствием из закона Гесса изменение энтальпии процесса равно:
∆ Н 0хр = (2∆ Н °(Н2О(г)) + ∆ Н °(CO2(г))) – (∆ Н °(CH4(г)) + 2∆ Н °(O2(г))) =
= (2 (-241,8) + (-393,5)) - ((-74,9) + 2 ∙ 0) = - 802,2 кДж.
Так как энтальпия системы в результате реакции убывает, то реакция идет с выделением тепла и является экзотермической.
Задача 2.
По уравнению Fe3O4(к) + 4H2(г) = 3Fe(к) + 4H2O(г) рассчитать тепловой эффект реакции при получении:
а) 1 кг железа; б) если прореагирует 1 моль H2; в) если образуется 1л водяных паров.
РЕШЕНИЕ. Запишем термохимическое уравнения реакции и выпишем табличные значения стандартных энтальпий образования веществ:
Fe3O4(к) + 4H2(г) = 3Fe(к) + 4H2O(г)
∆ Н °298, кДж/моль -1118 0 0 -241,8
В соответствии с 1-м следствием из закона Гесса изменение энтальпии процесса равно:
∆ Н °хр = 4∙∆ Н ° (Н2О(г)) – ∆ Н ° (Fe3O4(к)) = 4 ∙ (-241,8) – (-1118) = 150,8 кДж.
∆ Н °хр > 0, следовательно, данная реакция является эндотермической.
а) изменение энтальпии реакции в данном случае рассчитано на 3 моль железа (МFe= 56г/моль), т.е. на 3 ∙ 56 г = 168 г. Изменение энтальпии при получении 1кг железа определяется из соотношения:
168 г Fe – - 150,8 кДж
1000 г Fe – Х кДж,
Отсюда Х = - 897 кДж.
б) изменение энтальпии реакции в данном случае рассчитано на 4 моль водорода. Изменение энтальпии при участии 1моль водорода определяется из соотношения:
4 моль Н2 – - 150,8 кДж
1 моль Н2 – Х кДж,
Отсюда Х = - 37,7 кДж.
в) изменение энтальпии реакции в данном случае рассчитано на 4 моль водяных паров, т.е. на 4 ∙ 22.4 л = 89,6 л, где V м = 22,4л/моль. Изменение энтальпии при получении 1л водяного пара определяется из соотношения:
89,6 л Н2О – - 150,8 кДж
1 л Н2О – Х кДж
Отсюда Х = 1,67 кДж.
Задача 3
Определить верхний предел температуры, при которой может протекать процесс образования пероксида бария по реакции
2BaO(к) + O2(г) = 2BaO2(к).
Какой из факторов (энтальпийный или энтропийный) определяют направление самопроизвольного протекания реакции при низких и высоких температурах?
РЕШЕНИЕ. Изменение энтальпии реакции образования пероксида бария имеют ∆ Н °хр = 2∆ Н °ВаО2 - (2∆ Н °ВаО + ∆ Н °О2) = -634,7∙2 - (-553,9∙2 + 0) = -161,6 кДж.
Изменение энтропии
∆ S °хр =2 S °ВаО2 – (2 S °ВаО + S °О2) =77,5∙2 – (70,5∙2 + 206) = -191 Дж/К = - 0,191 кДж/К.
Свободная энергия этого процесса выразится уравнением ∆ G °хр = ∆ Н °хр- Т ∆ S °хр. При стандартных условиях ∆ G °хр = -161,6 + 0,191× 298 = -104,68 кДж. Так как ∆ G °хр < 0, реакция при стандартных условиях протекать может.
Температуру инверсии можно найти из соотношения ∆ G ° = 0. Отсюда следует:
∆ G °хр = ∆ Н °хр- Т ∆ S °хр = 0, а Т инв =  = 846,07 К.
= 846,07 К.
Выше температуры 846,07 К процесс образования BaO2 не может быть реализован.
Из расчетов следует, что ∆ Н °хр< 0 и ∆ S °хр< 0. При Т < 846,07К ∆ G °хр < 0 и, значит, знак ∆ G °хр определяется энтальпийным фактором (∆ Н °хр< 0). При Т > 846,07К ∆ G °хр меняет свой знак на положительный и определяющим становится энтропийный фактор.
Задача 4.
Вычислить изменение энтропии при испарении 250 г воды при 25 °С, если мольная теплота испарения воды (∆ Н °исп) при этой температуре равна 44,08 кДж/моль.
РЕШЕНИЕ. Процессы фазовых переходов происходят при условии постоянства свободной энергии Гиббса (∆ G °фп = 0). При испарении энтропия вещества возрастает на величину
∆ S исп= 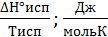 .
.
Количество воды, содержащееся в 250г составляют
ν = 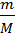 =
=  г = 13,88 моль.
г = 13,88 моль.
Отсюда теплота испарения 250 г воды равна:
∆ Н °= ν•∆ Н °исп = 13,88моль ∙ 44,08 кДж/моль = 611,83кДж = 611830Дж.
Изменение энтропии при испарении 250 г воды при Т =25 + 273 = 298К.
∆ S исп= 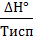 =
=  = 2050 Дж/К.
= 2050 Дж/К.

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!