Состояние химического равновесия является устойчивым, если в нем система обладает минимальным запасом свободной энергии. Это состояние может продолжаться сколь угодно долго при заданных условиях, т.е. пока параметры, при которых оно сформировалось, остаются неизменными. При изменении условий равновесие нарушится и сместится в ту или другую сторону. Через некоторое время в системе установится новое состояние равновесия, отвечающее новым условиям и новым равновесным концентрациям веществ. Равновесие смещается потому, что изменение условий по-разному влияет на скорость прямой и обратной реакций. Если при изменении внешних условий скорость прямой реакции возросла больше, чем у обратной, то говорят, что равновесие сместилось вправо.
Оценить направление смещения равновесия можно либо при анализе уравнений, описывающих закономерности данной реакции, либо на основе анализа общих принципов, позволяющих оценить результаты изменения внешних условий на равновесные системы.
Одним из таких принципов является принцип Ле Шателье.
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо внешнее воздействие, то равновесие сместится в сторону ускорения той реакции, которая приведет к уменьшению этого воздействия.
1. Изменение концентрации участников реакции. Изменение концентрации одного или нескольких реагентов в равновесной смеси приведет к смещению равновесия согласно уравнениям скорости для прямой и обратной реакций. Если увеличивается концентрация исходных веществ, то увеличивается скорость прямой реакции, тогда как скорость обратной остается неизменной. Это приведет к смещению равновесия вправо. Этот же эффект будет достигнут, если уменьшить концентрацию продуктов реакции, т.к. при этом скорость обратной реакции уменьшится, а скорость прямой останется постоянной. Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т.е. в сторону исходных веществ.
Согласно принципу Ле Шателье система в состоянии равновесия будет стремиться сохранить его. Увеличение концентрации исходных веществ сместит равновесие в сторону реакции, где они будут расходоваться вправо, а увеличение концентрации продуктов – влево. Также поведет себя система при уменьшении концентрации веществ. Снижение концентрации продуктов сместит равновесие в сторону реакции, где они будут восполняться, – вправо, а снижение концентрации исходных веществ – влево.
2.Влияние температуры. Из уравнения D G = -RT ln K следует, чтоln Kp = - 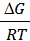 .
.
Учитывая, что D G = D H - T D S, получим ln Kp = - 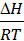 +
+  .
.
Таким образом, константа химического равновесия при повышении температуры может как повышаться, так и понижаться. Например, для экзотермических реакций (D Н хр <0), с ростом температуры К р уменьшается и равновесие сдвигается влево, а для эндотермических (D Н хр >0) К р увеличивается и равновесие смещается вправо.
В соответствии с принципом Ле Шателье увеличение температуры сместит равновесие в сторону реакции, где тепло будет поглощаться (в сторону эндотермической реакции). При уменьшении температуры система будет стремиться восполнить потери тепла и равновесие сместится в сторону реакции, где тепло выделяется (в сторону экзотермической реакции).
Следует помнить, что при увеличении температуры скорость всех реакций повышается. Однако скорость эндотермических реакций будет возрастать сильнее, чем у экзотермических.
3.Влияние давления. Давление оказывает воздействие только на концентрацию газов. Чем выше давление, тем больше концентрация. Концентрация жидкостей и твердых веществ от давления не зависит. Таким образом, влияние изменения внешнего давления на состояние равновесия определяется так же, как и влияние концентрации реагентов. Однако учитываются только газообразные вещества.
Принцип Ле Шателье позволяет предсказать направление смещения равновесия следующим образом. Увеличение давления смещает равновесие в сторону реакции, идущей с уменьшением объема, т.е. туда, где образуется меньшее количество газообразных веществ и воздействие давления минимально.
4.Влияние катализаторов. Для обратимых реакций присутствие катализатора не изменяет состояния равновесия. При введении в реакционную среду катализатора потенциальный барьер (энергия активации) уменьшается как для прямой, так и для обратной реакций. Катализатор лишь ускоряет наступление состояния равновесия за счет увеличения скоростей прямой и обратной реакций
РАСТВОРЫ
Растворами называют гомогенные системы, состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения гомогенных свойств.
Если несколько веществ привести в соприкосновение, то можно получить либо механическую смесь, либо однородную смесь, либо химическое соединение. Процесс образования раствора является промежуточным между механическим смешением веществ и химической реакцией. Состав растворов в достаточно широком интервале концентраций, температур и давлений может изменяться непрерывно. Растворы не имеют постоянного состава, и к ним не применимы законы стехиометрии. Это роднит их с механическими смесями. С другой стороны, растворы являются однородными по составу системами и их образование сопровождается значительными объемными и тепловыми эффектами, что напоминает образование химических соединений.
Принято различать истинные и коллоидные растворы, а также грубодисперсные системы. В истинных растворах вещества присутствуют в виде частиц с размерами ионов и молекул 10-9-10-10 м. Коллоидные растворы (золи) имеют размер частиц 10-7-10-9 м. Следующие за ними грубодисперсные системы, имеющие размер частиц больше 10-7см, являются неустойчивыми и без специальной стабилизации саморазрушаются, т.е. происходит расслоение системы на отдельные фазы.
Грубодисперсные системы подразделяют на СУСПЕНЗИИ - твердые частицы в жидкости и ЭМУЛЬСИИ- капли одной жидкости в другой. Типичной суспензией является система, полученная взбалтыванием глины в воде, а типичной эмульсией - молоко.
Примерами коллоидных систем являются водные растворы клея или желатина и АЭРОЗОЛИ - туман (капли жидкости в газе) и дым (твердые частицы в газе). Наиболее характерным отличием коллоидных растворов от истинных является то, что их более крупные частицы сильно рассеивают проходящий через них свет, чего не наблюдается у истинных растворов.
Истинные растворы подразделяют на газообразные (воздух), жидкие (морская вода) и твердые (сплавы).
В газообразном состоянии молекулы очень слабо взаимодействуют друг с другом. Поэтому при нормальном давлении газовые растворы можно считать механической смесью компонентов, однако размеры молекул газов позволяют отнести их к истинным растворам. При образовании газовых растворов объемные и тепловые эффекты не наблюдаются.
Твердые растворы - это системы с переменным составом, в которых частицы различных элементов располагаются в общей кристаллической решетке. Область существования твердых растворов обычно отличается достаточно узкими интервалами концентраций. Однако такие металлы, как медь и серебро, обладают практически полной взаимной растворимостью. Различают твердые растворы замещения и внедрения. В первых структурные единицы (атомы, ионы, молекулы) растворяющегося компонента замещают частицы растворителя в узлах
кристаллической решетки. Этот случай характерен для веществ, имеющих близкие размеры частиц и однотипные кристаллические решетки. Если же эти условия не соблюдаются, то могут образовываться твердые растворы внедрения. В этом случае происходит внедрение структурных единиц растворяемого компонента в междоузлия кристаллической решетки растворителя.
Жидкие растворы, как и все прочие, состоят из растворителя и растворенного вещества. Если растворяемое вещество – жидкость, то это деление условно. Обычно растворителем считают то вещество, которого в данной системе больше. Наиболее типичным и широко распространенным растворителем является вода.
ВОДА
Формула воды Н2О. Относительные весовые количества водорода и кислорода в этом веществе равны 2,016:16,000. В природной воде содержится примерно 99,73% таких молекул, остальное приходится на так называемую «тяжелую воду», где атомы водорода замещены на атомы дейтерия (изотоп водорода с массовым числом 2).
Вода - единственное в природе вещество, которое находится на земле одновременно в трех агрегатных состояниях – твердом, жидком и газообразном.
Вода – одно из наиболее распространенных в природе веществ. Ее запасы на земле оцениваются в 2,7÷2,9 млрд  км3.
км3.
Таблица 7.1
Вода в природе
| Содержание воды, млрд. км3
|
| Атмосфера
| Земная кора
| Гидросфера
|
| (1,3÷1,5)10-5
| 1,3÷1,4
| 1,4÷1,5
|
Вода, содержащаяся в гидросфере, на 96% сосредоточена в мировом океане и только 4% - в виде рек, озер, ледников и подземных вод. Запасы пресной воды составляют не более 3%.
При нормальных условиях вода является очень слабым электролитом, т.е. присутствует в растворах в основном в виде молекул, а не ионов.
Концентрация ионов гидроксония (Н3О+) и гидроксида (ОН-) в чистой воде при стандартных условиях равна 10-7моль/л.
Вода обладает рядом очень специфических свойств, отличающих ее от любых других веществ. Так, большинство веществ при снижении температуры уменьшаются в объеме, при этом увеличивается их плотность. Вода имеет максимальную плотность при температуре +3,980С. При дальнейшем понижении температуры ее объем начинает возрастать, а плотность снижаться. Плотность воды в твердой фазе ниже, чем в жидкой, поэтому лед плавает. Температура замерзания и кипения воды значительно выше, чем можно было ожидать в сравнении с родственными ей соединениями. У воды необычно высокая диэлектрическая проницаемость, что делает ее одним из сильнейших растворителей.
Для большинства твердых веществ у каждой из частиц в среднем 12 ближайших соседей, в жидкостях - 10¸11. У воды каждая молекула окружена
лишь четырьмя соседями, связанными с ней специфическими водородными связями, которые по энергии почти в 10 раз превышают электростатические силы. Водородные связи существуют как в твердом, так и в жидком состоянии. Поэтому даже в жидкой воде сохраняется квазистационарная кристаллическая решетка и молекулы имеют значительные ограничения в своей подвижности. Кипячение или другие сильные воздействия на воду разрушают эти «льдоподобные» структуры, что в значительной степени изменяет ее физико-химические свойства. Восстановление структуры и свойств воды требует нескольких дней. В настоящее время молекулярная структура воды до конца не выяснена.
ОБРАЗОВАНИЕ РАСТВОРОВ
В процессе растворения веществ изменяется как их структура, так и структура растворителя. Частицы вступают в новые типы взаимодействий, при этом изменяется состояние системы в целом. Процесс растворения сопровождается тепловыми и объемными эффектами. Например, при растворении 1л этилового спирта в 1л воды происходит выделение большего количества тепла, а объем образовавшегося раствора после охлаждения составляет 1,93л. Уменьшение объема связано с образованием водородных связей между молекулами спирта и воды и разрушением льдоподобных структур воды.
Физико-химический процесс взаимодействия молекул растворителя и молекул, ионов или атомов растворяемого вещества, в результате которого образуются сложные пространственные структуры, связанные воедино за счет различного рода взаимодействий, называется сольватацией (если растворитель вода, то гидратацией), а сами структуры сольватами (гидратами).
Тепловой эффект, наблюдаемый при растворении, следует рассматривать как результат ряда физических и химических явлений.
1.Разрушение химических и межмолекулярных связей в растворяющихся веществах. Этот процесс требует затрат энергии, которая поглощается системой из окружающей среды и, значит, изменение энтальпии процесса положительно D Н 1>0.
2.Физико-химическое взаимодействие растворяющегося вещества с молекулами растворителя с образованием сольватных структур. Этот процесс сопровождается выделением энергии в окружающую среду и, значит, энтальпия системы понижается, т.е. D Н 2<0.
3.Самопроизвольное перемешивание раствора, в результате которого концентрация сольватных структур по объему раствора выравнивается. Этот процесс требует небольших затрат энергии (D H 3>0). Вклад этой составляющей в общий тепловой эффект незначителен.
Таким образом, суммарный тепловой эффект процесса растворения складывается из трех составляющих, причем основное значение имеют первые две. D Н ра-я = D Н1+ D Н2+ D Н3.
В зависимости от соотношения этих трех величин суммарный тепловой эффект может быть как положительным, так и отрицательным.
При растворении в воде газов или жидкостей, у которых энергия химических связей между молекулами невелика, тепловой эффект, как правило, положителен.
В этом случае, в соответствии с принципом Ле Шателье, процессу растворения будет способствовать охлаждение системы, т.е. в холодной воде газы и жидкости растворяются лучше.
Для большинства кристаллических веществ энергия химической связи в кристаллах достаточно велика и для ее разрыва требуется значительная энергия. Поэтому растворение твердых веществ, как правило, сопровождается поглощением тепла и для интенсификации этого процесса требуется нагревание системы.
Процесс растворения является процессом самопроизвольным и протекает с убылью свободной энергии ( D G <0).
Так же, как и любой физико-химический процесс, его можно охарактеризовать соотношением энтальпийного и энтропийного факторов или величиной изменения свободной энергии Гиббса. При растворении газов в жидкостях энтропия системы убывает (г + ж = ж), а тепло выделяется (D Н <0) - процесс идет за счет энтальпийного фактора. При растворении большинства твердых веществ (тв + ж = ж) наоборот, энтропия системы возрастает, а тепло поглощается (D H >0) - процесс идет за счет энтропийного фактора. Таким образом, состояние равновесия, в процессе растворения достигается при условии равенства энтальпийного и энтропийного факторов, когда свободная энергия системы не изменяется.
В процессе растворения растворы называются ненасыщенными. В момент, когда энтальпийный и энтропийный факторы выравниваются, наступает состояние равновесия и раствор становится насыщенным. В этом состоянии избыток растворяемого вещества и раствор могут сосуществовать сколь угодно долго.
Если процесс растворения твердого вещества проводить при повышенной температуре до состояния насыщения, а затем медленно его начать охлаждать, то можно создать условия, при которых избыточное количество растворенного вещества в осадок выпадать не будет. Такой раствор называют пересыщенным. Система находится в состоянии неустойчивого равновесия и при малейшем воздействии разрушается.
Избыток растворенного вещества выпадает в осадок, а система переходит в состояние устойчивого равновесия. Существование пересыщенных растворов возможно потому, что процесс образования первичных кристаллических зародышей в объеме имеет незначительную энергию активации.
Концентрация вещества в насыщенном растворе характеризует его способность растворяться в данном растворителе. Эту концентрацию принято называть РАСТВОРИМОСТЬЮ.
Растворимость веществ колеблется в очень широких пределах. Так, например, в 100г воды может раствориться до 200г глюкозы или 1,3∙10-7г иодида серебра.
Растворимость веществ в конкретном растворителе зависит от большого числа факторов и в большинстве случаев предсказана быть не может. Тем не менее, многие наблюдаемые факты объясняются с точки зрения теории химической связи. Прежде всего, это зависит от соотношения энергии связей между частицами в кристаллах и энергией сольватации этих частиц.
Между этими величинами должно быть определенное соответствие. Максимум растворимости достигается в том случае, когда молекулярное поле кристалла близко по величине молекулярному полю растворителя. Однако в ряде случаев это правило нарушается. Так, в случае химического взаимодействия растворителя и растворяемого вещества растворимость обычно резко возрастает.
Кроме температуры и давления, большое влияние на растворимость вещества оказывают примеси. Обычно они снижают растворимость. Это объясняют тем, что снижается количество свободных молекул растворителя.
Растворение веществ может протекать по различным механизмам, среди которых в качестве примера можно выделить наиболее характерные.
1. Растворение газов, химически не взаимодействующих с растворителем. Например: растворение газообразного азота в воде.
Молекула N2 переходит из газовой фазы в жидкую практически не изменяясь. Энергия на разрыв связей с другими молекулами не затрачивается. Гидратация молекул сопровождается небольшим выделением тепла, поэтому температура раствора незначительно повышается.
Растворимость азота при 00С составляет 23,54 мл на 1л воды, и для ее
увеличения раствор необходимо охлаждать.
2. Процесс растворения газообразного хлористого водорода в воде имеет гораздо более сложную картину. Молекулы НС1 являются полярными за счет сдвига общей электронной плотности от атома водорода к атому хлора. В результате на атоме водорода наводится частичный заряд «+», а на атоме хлора частичный «-». Молекулы воды также полярны и являются диполями. Взаимодействие постоянных диполей НС1 и Н20 приводит к разрыву молекулы НС1 на два иона Н+ и Cl- (НС1→Н+ + Cl-). Этот процесс носит название «электролитическая диссоциация». Разрыв ковалентной связи в молекуле хлористого водорода требует значительных затрат энергии. Образовавщиеся ионы водорода и хлора вступают во взаимодействие с молекулами воды и гидратируются, при этом энергия в виде тепла выделяется в окружающую среду. Дополнительно к этому процессу гидратация иона водорода сопровождается химической реакцией образования иона гидроксония Н+ + Н20 = НЗО+. Образование ковалентной связи сопровождается выделением большого количества тепла.
В данном случае энергия, необходимая для разрыва связи Н-С1 (432 кДж/моль), компенсируется энергией, выделяющейся при образовании связи между протоном и молекулой воды в ионе гидроксония, а также энергией гидратации ионов гидроксония и ионов хлора. Процесс растворения хлористого водорода сопровождается значительным разогревом раствора, при этом растворимость хлористого водорода в воде аномально высокая.
В 1л воды при 200С растворяется порядка 300л хлористого водорода.
3. В ряде случаев растворяемое вещество уже в исходном виде состоит из ионов, например, ионные кристаллы NaCI построены из ионов Na+ и Cl-. При растворении кристалла происходит отрыв этих ионов от кристаллической решетки молекулами воды. Если сопоставить энергии кристаллической решетки и энергии
сольватации, то окажется, что они примерно одинаковы, т.е. энергия сольватации катиона и аниона может скомпенсировать энергию, необходимую для разрыва связей в кристалле. Растворение кристаллических веществ, как правило, процесс эндотермический и для повышения растворимости раствор необходимо нагревать.
Исследование свойств растворов в зависимости от внешних условий и их концентрации позволило установить, что эти свойства в значительной степени отличаются от свойств чистого растворителя. Давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем.
Температура кипения раствора всегда больше, а температура замерзания всегда меньше, чем у чистого растворителя (1 и 2 законы Рауля). Осмотическое давление в растворе возрастает по мере его концентрирования (Вант Гофф). В этих законах изменение свойств находится в определенной зависимости от числа растворенных частиц вещества.
Законы Рауля и Вант Гоффа справедливы только для очень разбавленных растворов. По мере их концентрирования наблюдаются все большие отклонения. Это обусловлено различного рода взаимодействиями между частицами в растворе. Учесть все эти взаимодействия практически невозможно. Было предложено описывать свойства реальных растворов при помощи законов для идеальных, но заменить в них концентрацию вещества на его активность.
а = f C, (7.1)
где f -коэффициент активности, который формально учитывает все виды взаимодействий между частицами в растворе, приводящие к отклонениям от идеальных растворов.
Коэффициент активности вычисляют на основании экспериментальных данных как частное от деления экспериментального значения какой-либо величины на ее теоретическое значение. f - величина безразмерная.



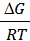 .
.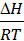 +
+  .
. км3.
км3.


