В растворах солей, образованных катионами слабого основания и анионами слабой кислоты (NH4CN, CH3COONH4, (NH4)2S, (NH4)2CO3 и др.) гидролиз идет по катиону и аниону одновременно. Растворы солей этого типа могут иметь слабокислую, слабощелочную или нейтральную реакцию в зависимости от величины констант диссоциации образующихся при гидролизе кислот и оснований:
а) если 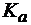 >
>  , то реакция раствора слабокислая;
, то реакция раствора слабокислая;
б) если 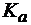 <
<  , то реакция раствора слабощелочная;
, то реакция раствора слабощелочная;
в) если 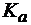 =
=  , то реакция раствора нейтральная.
, то реакция раствора нейтральная.
Пример 5. Гидролиз ацетата аммония CH3COONH4.
Решение.
Эта соль образована слабой кислотой (CH3COOH) и слабым основанием (NH3∙H2O). Гидролиз данной соли протекает c образованием двух малодиссоциированных соединений:
CH3COONH4 + H-OH ⇄ NH3×H2O + CH3COOH,
CH3COO- + NH4+ + H-OH ⇄ NH3×H2O + CH3COOH.
 (NH3×Н2О) = 1,8×10-5;
(NH3×Н2О) = 1,8×10-5;
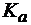 (СН3СООН) = 1,8×10-5,
(СН3СООН) = 1,8×10-5,
pH» 7 (нейтральная среда).
Пример 6. Гидролиз карбоната аммония (NH4)2СO3.
Решение.
Гидролиз данной соли протекает ступенчато:
первая ступень:
(NH4)2СO3 + H-OH ⇄ NH3×H2O + NH4HСO3,
NH4+ + СO32- + H-OH ⇄ NH3×H2O + HСO3-;
вторая ступень:
NH4HСO3 + H-OH ⇄ NH3×H2O + H2СO3,
NH4+ + HСO3- + H-OH ⇄ NH3×H2O + H2СO3.
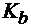 (NH3×Н2О) = 1,8×10-5,
(NH3×Н2О) = 1,8×10-5,
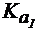 (Н2СО3) = 3,7×10-7,
(Н2СО3) = 3,7×10-7,
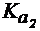 (Н2СО3) = 4,7×10-11,
(Н2СО3) = 4,7×10-11,
pH > 7 (слабощелочная среда).
Из приведённых примеров видно, что гидролизсолей, образованных многозарядными катионами или анионами, протекает ступенчато, но самопроизвольно не доходит до конца (т. е. до образования кислоты и основания, образующих данную соль). Гидролиз по первой ступени протекает в большей степени, чем по последующим ступеням. Это связано с тем, что при гидролизе по первой ступени в растворе увеличивается концентрация ионов Н+ или ОН-, что препятствует дальнейшему протеканию процесса.
Необратимыйгидролиз (т. е. самопроизвольно протекающий до конца) встречается у некоторых солей, образованных катионами слабого основания и анионами слабой кислоты, если оба продукта гидролиза удаляются из раствора в виде осадка и газа. Для таких солей в соответствующей клетке таблицы растворимости стоит прочерк. Вследствие полного гидролиза такие соли в водном растворе не существуют.
Пример 7. Гидролиз сульфида алюминия Al2S3 (в таблице растворимости – прочерк).
Решение.
При растворении этой соли в воде протекает необратимый процесс гидролиза:
Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S
Необратимый гидролиз необходимо учитывать при написании уравнений реакций, протекающих между электролитами в водных растворах.
Пример 8. Смешали водные растворы Na2CO3 и FeCl3. Написать уравнение протекающей реакции.
Решение.
Здесь имеет место взаимный гидролиз, т.е. гидролиз одной соли усиливает гидролиз другой соли. Таким образом, процесс гидролиза самопроизвольно идет до конца, т. е. до образования малораст-воримого гидроксида железа (III) Fe(OH)3 и углекислого газа СО2:
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3¯ + 3CO2 + 6NaCl
3СO32- + 2Fe3+ + 3H2O = 2Fe(OH)3 + 3CO2



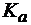 >
>  , то реакция раствора слабокислая;
, то реакция раствора слабокислая;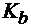 (NH3×Н2О) = 1,8×10-5,
(NH3×Н2О) = 1,8×10-5,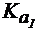 (Н2СО3) = 3,7×10-7,
(Н2СО3) = 3,7×10-7,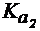 (Н2СО3) = 4,7×10-11,
(Н2СО3) = 4,7×10-11,


