1. Образование простых и сложных эфиров (аналогично биозам).
2. Качественная реакция – окрашивание при добавлении иода: для амилозы – в синий цвет, для амилопектина – в красный цвет.
3. Кислый гидролиз крахмала: крахмал → декстрины → мальтоза → α-D-глюкоза.
Целлюлоза. Структурный полисахарид растений, построен из остатков β-D-глюкопиранозы, характер соединения 1β-4. Содержание целлюлозы, например, в хлопчатнике – 90–99 %, в лиственных породах – 40–50 %. Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенки растительных клеток.
Характеристика химических свойств
1. Кислый гидролиз (осахаривание): целлюлоза → целлобиоза → β-D-глюкоза.
2. Образование сложных эфиров
a)

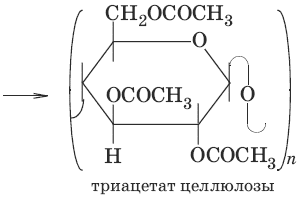
Из растворов ацетата целлюлозы в ацетоне изготавливают ацетатное волокно.
б)
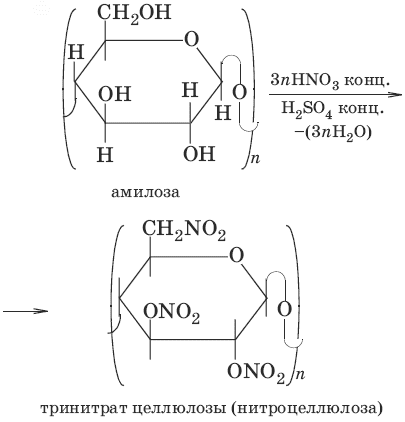
Нитроцеллюлоза взрывоопасна, составляет основу бездымного пороха. Пироксилин – смесь ди– и тринитратов целлюлозы – используют для изготовления целлулоида, коллодия, фотопленок, лаков.
V. ФИЗИЧЕСКАЯ ХИМИЯ
Основные понятия термодинамики
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Параметры состояния – величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы.
Термодинамический процесс – всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния).
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Равновесный процесс – процесс, при котором система проходит через непрерывный ряд состояний, бесконечно близких к состоянию равновесия. Характерные особенности равновесного процесса:
1) бесконечно малая разность действующих и противодействующих сил: Fex – Fin → 0;
2) совершение системой в прямом процессе максимальной работы | W | = max;
3) бесконечно медленное течение процесса, связанное с бесконечно малой разностью действующих сил и бесконечно большим числом промежуточных состояний t → ∞.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать обратимо или необратимо.
Несамопроизвольный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Внутренняя энергия системы U – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как ее полную энергию за вычетом кинетической и потенциальной энергии системы как целого. [ U ] = Дж.
Теплота Q – форма передачи энергии путем неупорядоченного движения молекул, путем хаотических столкновений молекул двух соприкасающихся тел, т. е. путем теплопроводности (и одновременно путем излучения). Q > 0, если система получает теплоту из окружающей среды. [ Q ] = Дж.
Работа W – форма передачи энергии путем упорядоченного движения частиц (макроскопических масс) под действием каких-либо сил. W > 0, если окружающая среда совершает работу над системой. [W] = Дж.
Вся работа делится на механическую работу расширения (или сжатия) и прочие виды работы (полезная работа): δ W = —pdV + δW′.
Стандартное состояние твердых и жидких веществ – устойчивое состояние чистого вещества при данной температуре под давлением р = 1атм.
Стандартное состоянии чистого газа – состояние газа, подчиняющееся уравнению состояния идеального газа при давлении 1 атм.
Стандартные величины – величины, определенные для веществ, находящихся в стандартном состоянии (обозначаются надстрочным индексом 0).
Первое начало термодинамики
Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений.
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой W и изменением внутренней энергии системы Δ U.
Изолированная система
Внутренняя энергия изолированной системы остается постоянной.
U = const или dU = 0
Закрытая система
Изменение внутренней энергии закрытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой.
ΔU =Q +W или dU = δ Q + δ W
Открытая система
Изменение внутренней энергии открытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой, а также за счет изменения массы системы.
Δ U =Q +W + ΔUm или dU = δ Q + δ W + i ΣU i dn i
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии Δ U не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях:
ΔU =U2 – U1
Для некоторого процесса:
ΔU = Σ(viUi)npoд – Σ(viUi)исх









