

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
2.1. (2 часа) Внутренняя энергия идеального газа. Работа термодинамической системы. Количество теплоты. Теплоемкость. Закон равномерного распределения энергии по степеням свободы.
Внутренняя энергия (U) – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер т.д.) и энергия взаимодействия этих частиц. К внутренней энергии относится также движение системы, как целого, и потенциальная энергия системы во внешних полях.
Число степеней свободы. Атом одноатомного газа рассматривают как материальную точку, которой приписывается три степени свободы поступательного движения (i=3). Молекула двухатомного газа имеет пять степеней свободы (i=5) – три поступательного и две –вращательного. Трехатомная молекула имеет i=6, три - поступательного и три вращательного. Для молекул реальных газов атомы не связаны жестко, и еще надо учитывать колебательное движение атомов.
Закон Больцмана о равновесном распределении энергии по степеням свободы: для термодинамической системы на каждую степень свободы, поступательную и вращательную – приходится кинетическая энергия  , а на каждую колебательную -
, а на каждую колебательную -  (Из-за потенциальной и кинетической энергии).
(Из-за потенциальной и кинетической энергии).
Средняя энергия молекул  , (123) где
, (123) где  . В классической теории рассматриваются молекулы с жесткой связью между атомами, т.е. колебательное движение не учитывается.
. В классической теории рассматриваются молекулы с жесткой связью между атомами, т.е. колебательное движение не учитывается.
Внутренняя энергия газа определяется лишь кинетической энергией его молекул:
 (124)
(124)
Работа термодинамической системы (твердых, жидких и газообразных тел):
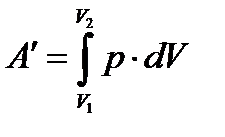 .
.  , работа внешних сил (А).
, работа внешних сил (А).
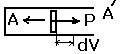
Графический смысл работы – это площадь под кривой в координатах Р и V.
Первое начало (первый закон) термодинамики:
Изменение внутренней энергии системы равно работе внешних сил плюс количество переданной теплоты:
|
|
 (125)
(125)
 или
или  (126)
(126)
Количество теплоты, переданное системе, расходуется на изменение ее внутренней энергии ( ) и совершение системой работы (
) и совершение системой работы ( ).
).
Удельная теплоемкость вещества – количество теплоты, необходимое для нагревания 1 кг вещества на 1 К:

 (127)
(127)
Молярная теплоемкость – количество теплоты, необходимое для нагревания 1 моля вещества на 1 К:
 (128)
(128)



 I закон термодинамики для 1 моля:
I закон термодинамики для 1 моля:
 (129)
(129)
Молярная теплоемкость при постоянном объеме ( , то
, то 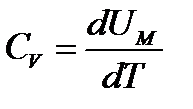 , (130)
, (130)
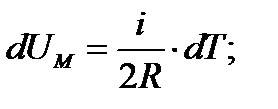
 (131)
(131)
Если газ нагревается при постоянном давлении, то 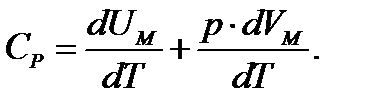
 -независит от вида процесса, а зависит отТ и всегда равна
-независит от вида процесса, а зависит отТ и всегда равна  ,то
,то
 (132)
(132)
Из уравнения Менделеева-Клапейрона  найдем
найдем  , (132)- уравнение Майера. Из (132):
, (132)- уравнение Майера. Из (132):  (133)
(133)
Применение I закона термодинамики к различным процессам:
1) Изохорный, 
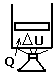




2) Изобарный, 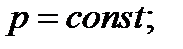




 -для одноатомного газа;
-для одноатомного газа; 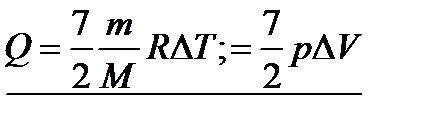 -для двухатомного газа; или в общем:
-для двухатомного газа; или в общем: 
3) Изотермический, 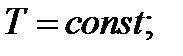


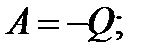



4) Адиабатный; 




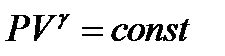 -уравнение Пуассона или
-уравнение Пуассона или 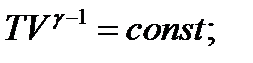


 - показатель адиабаты или коэффициент Пуассона.
- показатель адиабаты или коэффициент Пуассона.
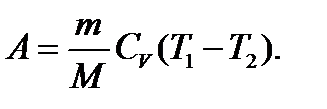 (134)
(134)
При адиабатном расширении
 (135)
(135)
Лекция 13 2.2. (2 часа) Первый закон термодинамики (см. ранее). Обратимые и необратимые процессы. Циклические процессы. Цикл Карно. Коэффициент полезного действия тепловых машин. Второй закон термодинамики.
Обратимым называется такой процесс, который происходит как в прямом, так и в обратном направлениях при отсутствии изменений в окружающей среде. Любой обратимый процесс является равновесным. Обратимые процессы – это идеализация реальных процессов. Все другие процессы – необратимы.
Круговым процессом (или циклом) называется процесс при котором система, пройдя через ряд состояний, возвращается в исходное. Прямой цикл (рис.29)используется в тепловых двигателях, обратный – в холодильных машинах.

Рис.29
КПД –коэффициент полезного действия для кругового процесса:
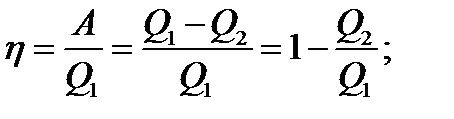 (136)
(136)
 - количество теплоты, полученное от нагревателя;
- количество теплоты, полученное от нагревателя;
 - количество теплоты, отданное холодильнику.
- количество теплоты, отданное холодильнику.
|
|
 <1.
<1.
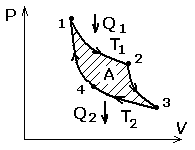
Рис.30
Цикл Карно, его диаграмма состоит из двух изотерм и двух адиабат. 1-2, 3-4 – изотермы; 2-3,4-1 – адиабаты.
Цикл Карно обладает наибольшим КПД:
 , или
, или  , или
, или 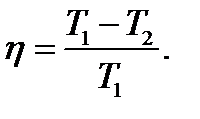 (137)
(137)
 - температура нагревателя;
- температура нагревателя;
 - температура холодильника.
- температура холодильника.
Как повысить КПД. Например, при  и
и  , η = 0,25.
, η = 0,25.
Второй закон термодинамики:
1) По Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
2) По Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
 .Если бы можно было
.Если бы можно было  передать к нагревателю, то
передать к нагревателю, то  ; и
; и 
По Клаузиусу – тепловая смерть Вселенной из-за выравнивания температуры во Вселенной. Ошибочность: бесконечную Вселенную нельзя рассматривать как замкнутую (изолированную).
2.3. (2 часа) Энтропия и ее статистическая интерпретация. Возрастание энтропии при неравновесных процессах. Границы применимости второго закона термодинамики. Представление о термодинамике открытых систем.
Энтропия. Физическая интерпретация (смысл) этого понятия рассматривается как отношение теплоты ( ), полученной телом в изотермическом процессе, к температуре (
), полученной телом в изотермическом процессе, к температуре (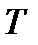 ) теплоотдающего тела, называемое приведенным количеством теплоты.
) теплоотдающего тела, называемое приведенным количеством теплоты.
 . (138)
. (138)
Изменение энтропии в любом круговом обратимом процессе равно нулю:  . Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов). Физический смысл имеет не сама энтропия, а ее изменение, т.е. разность энтропий:
. Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов). Физический смысл имеет не сама энтропия, а ее изменение, т.е. разность энтропий:
 (139)
(139)
Адиабатный процесс (обратимый) протекает без изменения энтропии, поэтому называется изоэнтропийным.
При изотермическом процессе (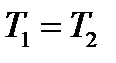 )
) 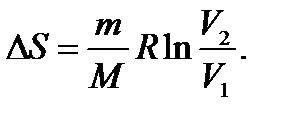 (140)
(140)
При изохорном процессе (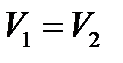 )
)  (141)
(141)
Энтропия обладает свойством аддитивности, т.е. энтропия системы равна сумме энтропий тел, входящих в систему. Аддитивностью обладают: внутренняя энергия, масса, объем (температура и давление таким свойством не обладают).
Согласно Больцману (1872) энтропия системы и термодинамическая вероятностьсвязаны между собой следующим образом:
 . (142)
. (142)
Т.е. энтропия – это мера вероятности состояния термодинамической системы. Энтропия является мерой неупорядоченности системы. Чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия – энтропия максимальна. Все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии.
|
|
Второй закон термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Второй закон термодинамики не применим к Вселенной, т.к. ее нельзя рассматривать как замкнутую.
Для открытых систем второй закон термодинамики не действует, т.е. тепло может передаваться от менее нагретых тел к более нагретым за счет процессов, протекающих вне открытой системы. Пример: холодильник. Энтропия открытых систем также может возрастать и убывать за счет теплообмена с внешними телами.
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!