

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
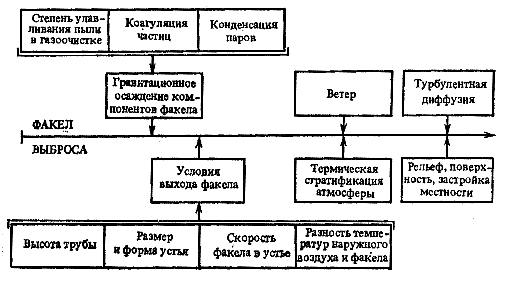 Рис. 2.8. Схема факторов, учтенных в ОНД-86
Рис. 2.8. Схема факторов, учтенных в ОНД-86
|
После выхода из источника загрязнения не остаются в атмосфере в неизменном виде. Происходят физические изменения, особенно в процессе динамических явлений, таких как перемещение и распространение в пространстве, турбулентная диффузия, разбавление и т. д. Кроме того, в результате химических процессов в атмосфере также происходят изменения. Часто это лишь простые быстрые химические реакции (например, окисление), температурные изменения, приводящие к конденсации некоторых газов и паров, сопровождающиеся образованием туманов, капель и т. п. После длительного пребывания некоторых газообразных загрязняющих веществ в атмосфере они превращаются в твердые, чрезвычайно тонкодисперсные частицы. Солнечное излучение вызывает в атмосфере химические реакции между различными загрязняющими веществами и окружающей их средой. На рис. 2.9 приведены упрощенные схемы основных химических изменений загрязняющих веществ в атмосфере.
Наиболее часто происходящий в атмосфере химический процесс — окисление веществ кислородом воздуха. Так, в атмосфере происходит окисление диоксида серы в триоксид и оксида азота в диоксид. Аналогичным образом окисляются многие органические вещества, например, альдегиды до органических кислот, ненасыщенные углеводороды и множество других веществ. Скорость окисления неодинакова для различных веществ и зависит от ряда дополнительных факторов.
Например, вследствие очень быстрого окисления оксида азота кислородом воздуха рыжий «хвост» диоксида азота появляется непосредственно на выходе оксида азота из дымовой трубы производства азотной кислоты. В сухом чистом воздухе диоксид серы сохраняется в течение 2–4 или более дней, прежде чем полностью превратится в триоксид. При высокой влажности и в присутствии твердых веществ, катализирующих окисление, полупериод реакции составляет 10–20 мин. За это время половина диоксида серы превращается в триоксид. Однако вследствие кинетики этой реакции полное окисление второй половины может занять от нескольких часов до нескольких суток.
|
|
 Рис. 2.9. Примеры превращений в атмосфере
Рис. 2.9. Примеры превращений в атмосфере
|
Помимо влажности и наличия суспендированных твердых частиц ускорить реакции окисления могут такие факторы как ультрафиолетовое излучение, а также наличие сильных оксидантов либо их вторичное формирование. К этим веществам относятся озон, пероксиды и атомарный кислород, которые образуются в ходе многих фотохимических реакций.
Под действием ультрафиолетового излучения приходящего от Солнца также возникают циклические реакции так называемые циклы Чепмена, которые представляют собой процесс ответственный за разрушение озонового слоя. Солнечный свет с длиной волны в диапазоне 290–700 нм является фотохимически эффективным, а вещества, поглощающие такое излучение, могут действовать как основные фотохимические реагенты, либо как фоточувствительные датчики, которые переносят поглощенную энергию к молекулам веществ, способных претерпевать указанные превращения.
В число первичных веществ, поглощающих ультрафиолетовое излучение, входят сера, диоксид азота и альдегиды. Это излучение возбуждает молекулы указанных веществ, которые затем реагируют с молекулярным кислородом атмосферы с образованием атомарного кислорода. Диоксид серы поглощает излучение при длинах волн от 290 до 400 нм, так что окисление диоксида серы в триоксид в атмосфере происходит под действием солнечного света значительно быстрее. Эта реакция описывается уравнением
hn
SO2 + O2 ® SO3 + O.
Аналогичным образом реагируют и альдегиды:
hn
НСНО + О2 ® НСООН + О.
|
|
Атомарный кислород может также образоваться по реакциям
H2S + O2 ® H2O + S + O;
NO + O2 ® NO2 + O;
CH4 + O2 ® CH3OH + O;
C2H6 + O2 ® C2H4 + H2O + O;
CO + O2 ® CO2 + O.
Реакции с участием диоксида серы и альдегидов протекают необратимо. В то же время количество атомарного кислорода, образующегося при этом, относительно невелико, что соответствует содержанию диоксида серы и альдегидов в атмосфере. Однако при реакциях, в которых участвует диоксид азота, поглощение ультрафиолетового излучения приводит к разрыву одной связи между атомами азота и кислорода и образованию молекулярного кислорода и оксида азота. Последующие реакции приводят к образованию молекулярного кислорода и озона и регенерации диоксида азота. Эти процессы можно представить в виде:
hn
NO2 ® NO + O;
NO2 + O2 ® NO + O2;
O + O2 ® O3.
Регенерированный диоксид азота может вновь вступить в реакцию, и, таким образом, этот процесс может многократно повторяться до тех пор, пока диоксид азота не превратится в азотную кислоту, либо не прореагирует с органическими веществами с образованием нитросоединений. Следовательно, даже малые концентрации диоксида азота в атмосфере могут явиться причиной значительных количеств атомарного кислорода и озона. Именно поэтому диоксид азота занимает важное место в формировании окислительного смога.
Существует два основных типа смогов: восстановительный — типичный для Лондонского региона и фотохимический окислительный — типичный для зоны Лос-Анджелеса.
Восстановительный смог — это атмосферное явление, встречающееся в больших промышленных городах и представляющее собой смесь дыма, сажи и диоксида серы. Обычно он достигает максимальных уровней рано утром, при температуре около 0°С и высокой влажности и дополняется состоянием инверсии в атмосфере (отражательная или поверхностная инверсия). За счет раздражающего воздействия на бронхи и дыхательные пути он оказывает прямое отрицательное воздействие на здоровье людей. В 1952 и в 1962 г, этот смог составил значительную долю загрязнения атмосферы Лондона и привел к смерти нескольких тысяч человек. Это стимулировало принятие радикальных мер по борьбе с загрязнением воздуха в Лондоне и привело к существенному улучшению состояния атмосферы в нем, причем настолько заметному, что в указанном регионе более не образовывался подобный смог.
|
|
Фотохимический окислительный смог достигает максимального уровня около полудня, при температурах 24–32°С и низкой влажности и дополняется нисходящей инверсией. Он вызывает раздражение глаз и снижения уровня зрения, нарушает процессы вегетации, окисляет резину и вызывает быстрое ее старение, а также имеет неприятный запах. Основным условием формирования такого смога является наличие в атмосфере оксидов азота. Фотохимическое разложение диоксида азота и другие указанные выше реакции инициируют серию последующих реакций, в которых участвуют как неорганические (преимущественно диоксид серы), так и органические (преимущественно углеводороды) вещества, присутствующие в атмосфере. Весьма обширный набор конечных продуктов включает озон, формальдегид, акролеин, органические озониды и органические кислоты. Снижение видимости связано с образованием аэрозолей, одной из составляющих которых является триоксид серы — продукт окисления диоксида.
Весьма важным в процессе образования окислительного смога являются также реакции ненасыщенных углеводородов с озоном. Наибольший вклад в его формирование и в нарушение вегетации вносят ненасыщенные углеводороды с пяти — и шестиуглеродными цепочками (1-пентен, 1-гексен). Ненасыщенные углеводороды с семи — и девятиуглеродными цепочками также приводят к образованию озонидов и других продуктов, но наносимый ими ущерб процессам вегетации уже несколько меньше. Встречаются и весьма сложные реакции с образованием дополнительных соединений в качестве промежуточных продуктов, а также с появлением свободных радикалов по мере разложения этих продуктов. При фотохимических реакциях альдегидов и кетонов тоже могут образовываться свободные радикалы. Например, формил (НСО*) образуется из формальдегидов, а метил и ацетил из ацетона
(СН3–СО–СН3 ® СН3* + СН3СО*).
За этими реакциями могут последовать и другие, с получением разнообразных продуктов. В воздухе свободные радикалы быстро реагируют с кислородом, с образованием пероксидов и органических кислот. Таким образом, из ацетальдегида образуется диметилпероксид и уксусная кислота.
|
|
Олефины с большим количеством двойных связей также вступают в фотохимические реакции с образованием свободных радикалов. При взаимодействии с кислородом некоторые свободные радикалы могут образовать пероксисоединения, из которых выделяются новые пероксиды или свободные радикалы, способные вызвать полимеризацию олефинов или стать источником озона.
Возможность протекания атмосферных реакций в значительной степени зависит от количества твердых частиц воздуха и от их свойств. Эти частицы создают поверхности, на которых могут протекать реакции, играя, таким образом, роль катализатора, либо за счет адсорбции газов частицы воздействуют на спектр поглощения (например, в диапазоне длин волн поглощенного излучения) и, следовательно, также влияют на интенсивности поглощения излучений и фотохимических реакций. Более того, в ходе широко известных химических реакций твердые частицы могут реагировать с газовыми выбросами промышленности.
Глава 3
|
|
|

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!