Тромболитические средства
Восстановление артериальной проходимости, предотвращение дальнейшего тромбообразования, в том числе и микротромбов, нарушающих тканевой кровоток, — одна из основных задач в лечении острого инфаркта миокарда.
При этом, хотя процессы гиперкоагуляции могут носить распространенный характер, основное внимание уделяется, естественно, коронарному кровообращению.
Можно считать доказанной возможность спонтанного тромболизиса.
Однако для многих больных восстановление коронарного кровотока возможно лишь с помощью специальных мероприятий.
К тому же и спонтанный лизис обтурирующего коронарную артерию тромба может произойти в относительно поздние сроки.
В растворении фибринового тромба главную роль играет плазмин.
В плазме крови в значительном количестве содержится его неактивный предшественник плазминоген.
Эндотелий сосудов постоянно выделяет в сосудистое русло мощный фактор — тканевой активатор плазминогена, который в свою очередь нейтрализуется специфическим ингибитором активатора плазминогена.
Образующийся же в крови плазмин инактивируется другим специфическим ингибитором — а2-антиплазмином. Вся эта система находится в постоянном равновесии.
Если активность ингибиторов снижается и тем самым увеличивается образование плазмина в крови и замедляется его нейтрализация, плазмин может оказать фибринолитическое действие.
Спонтанный тромболизис с реканализацией коронарной артерии может произойти слишком поздно, когда гибель кардиомиоцитов уже неизбежна.
В то же время даже ранняя — спонтанная или индуцированная — реканализация необязательно сопровождается восстановлением кровотока и питания кардиомиоцитов.
Причиной этого могут стать отек кардиомиоцитов с застоем в капиллярах и нарушением микроциркуляции, а также «реперфузионное кровоизлияние» вследствие некроза элементов сосудистой стенки и просачивания крови.
В экспериментальных и клинических исследованиях показано, что в первые часы после возникновения инфаркта миокарда эффективная тромболитическая терапия существенно ограничивает размеры некроза миокарда, причем эффект тем больше, чем раньше начато лечение.
Тромболитическая терапия может осуществляться с помощью системного (внутривенное введение) и внутрикоронарного (впервые осуществленного Е.И. Чазовым и М.Я. Рудой) введения препаратов.
Создание высокой концентрации тромболитика непосредственно в коронарном русле должно повысить вероятность восстановления проходимости артерии и уменьшить число осложнений.
Однако применение обоих методов у сопоставимых групп больных показало, что частота успешного тромболизиса различается не столь разительно и зависит преимущественно от времени, прошедшего от появления болей до начала тромболитической терапии, и соблюдения методических требований относительно доз препаратов и контроля их эффективности.
Помимо сложности организации экстренного проведения ангиокоронарографии в любое время суток, на ее осуществление тратится драгоценное время (по аналогии с известным афоризмом «Время — деньги» появилось выражение «Время — миокард»). Поэтому обычно проводится системный тромболизис.
Если же имеются условия для проведения внутри-коронарных вмешательств, то стремятся осуществить экстренную чрескожную коронароангиопластику.
В нескольких многоцентровых исследованиях, охвативших (вместе с контрольной группой) 58 600 пациентов, показано достоверное снижение летальности при введении тромболитиков в течение 12 ч после возникновения инфаркта миокарда.
При этом наиболее впечатляющие результаты достигнуты в тех группах больных, где тромболитики применяются в течение первых двух часов (особенно в течение первого часа — «золотой час тромболизиса»: снижение летальности — в срок до пяти недель — почти на 27%); в более поздние сроки эффект постепенно снижается [Fibrinolitic Therapy Collaborative Group, 1994].
Следует отметить, что снижение летальности происходит в группах больных с подъемом сегмента ST или со свежей блокадой ножки пучка Гиса, там же, где инфаркт миокарда протекает с депрессией сегмента ST, эффективность тромболитиков не доказана (сюда не входят больные, у которых в первые часы от начала приступа депрессия сегмента ST сменилась его подъемом).
Вместе с тем вопрос о сроке от начала инфаркта миокарда, в течение которого можно получить эффект от тромболитической терапии, не до конца понятен.
В ряде случаев пациент не может точно указать время начала ангинозного приступа, тем более когда имеется серия приступов различной продолжительности.
Частота восстановления коронарного кровотока даже при проведении тромболизиса в течение 12—24 ч от начала инфаркта миокарда может достигать 50%.
Кроме того, даже позднее восстановление кровотока улучшает репарацию миокарда и предотвращает его постинфарктное ремоделирование.
По-видимому, необходимо изучение более отдаленных результатов «позднего» тромболизиса, однако уже сейчас представляется целесообразным введение тромболитика при рецидивирующих ангинозных приступах и сохраняющейся элевации ST>O,1— 0,2 mV не менее чем в двух отведениях, даже если болевой приступ начался за 12—24 ч до предполагаемого введения тромболитика.
При наличии некупирующейся симптоматики острой левожелудочковой недостаточности (кардиогенный шок и/или отек легких), сохраняющейся элевации ST и невозможности провести экстренную баллонную ангиопластику также показано введение тромболитика через 12—24 ч от начала ангинозного приступа, поскольку тромболизис в данном случае является единственной реальной попыткой улучшить прогноз и предотвратить летальный исход.
В настоящее время в нашей стране используются активаторы плазминогена — препараты нативной стрептокиназы (стрептаза, целиаза, кабикиназа, авелизин и др.), урокиназа и проурокиназа, тканевой активатор плазминогена.
В последнее время спектр тромболитиков пополнился анистреплазой — комплексом стрептокиназы и человеческого плазминогена (anisoylated plasminogen streptokinase activator complex — APSAC).
Показаниями к применению тромболитиков у больных ишемической болезнью сердца являются развивающийся инфаркт миокарда с подъемом сегмента ST свыше 0,1 mV не менее чем в двух отведениях, а так-
же со свежей (хотя бы предположительно) блокадой левой ножки пучка Гиса и с давностью от начала приступа не более 12 ч, затяжное и рецидивирующее течение инфаркта миокарда, тромбоэмболические осложнения в большом и малом круге кровообращения.
Обсуждается целесообразность введения тромболитиков и в более поздние сроки для улучшения состояния или даже спасения относительно долго сохраняющейся перинекротической зоны ишемизированного миокарда.
Выделяют абсолютные и относительные противопоказания к тромболитической терапии.
В рекомендациях Американской коллегии кардиологов и Американской ассоциации сердца («1999 Up Date: ACC/AHA Guidelines for the management of patients with Acute Myocardial Infarction») приводятся следующие абсолютные противопоказания к тромболизису: геморрагический инсульт любой давности; другие нарушения мозгового кровообращения (включая транзиторные ишемические атаки) в течение последнего года; внутричерепные опухоли; внутреннее кровотечение (за исключением месячных); подозрение на диссекцию аорты.
Относительные противопоказания (необходима особая осторожность):
АД свыше 180/110 мм рт. ст. к моменту предполагаемого начала тромболизиса;
цереброваскулярные расстройства или внутричерепная патология, не отнесенные к абсолютным противопоказаниям;
проводимое лечение антикоагулянтами при международном нормализованном отношении > 2—3;
геморрагические диатезы, травмы в последние 2—4 нед., включая травматичную или длительную (более 10 мин) сердечно-легочную реанимацию;
большие хирургические вмешательства в последние 3 нед.; пункции сосудов, не поддающихся компрессии;
недавнее (2—4 нед.) внутренне кровотечение; беременность; открытая пептическая язва;
длительная тяжелая артериальная гипертензия в анамнезе.
Не рекомендуется вводить стрептокиназу при проводившемся с ее помощью тромболизисе в прошлом — особенно в сроки до двух лет, но, возможно, и в гораздо большие сроки; поскольку при первом введении произошла выработка антител и повторная инъекция может вызвать тяжелые аллергические реакции.
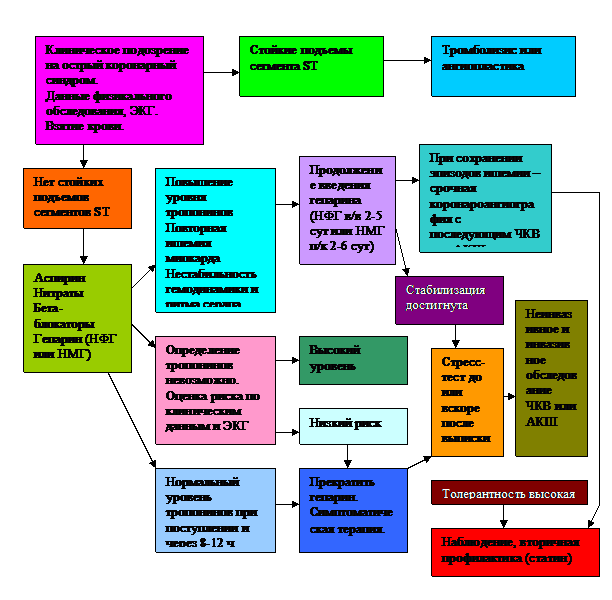
Тактика лечения при остром коронарном синдроме
Существует несколько схем введения стрептокиназы в остром периоде инфаркта миокарда.
Схемы введения различаются по «агрессивности», при этом выбор той или иной схемы определяется в основном наличием или отсутствием симптоматики сердечной недостаточности, обусловленной систолической дисфункцией миокарда.
При отсутствии симптомов или их незначительной выраженности обычно применяется «стандартная» схема введения стрептокиназы: первая болюсная доза в 500 тыс. ME, вводимая в течение 3—5 минут, с последующей капельной инфузией 1 млн ME в течение 60 мин.
При наличии симптомов кардиогенного шока и/или отека легких (сердечная недостаточность 3—4 класса по Killip—Wolk) возможно применение более агрессивных схем:
— болюсная доза 500 тыс. ME с последующей капельной инфузией 1 млн ME в течение 30 мин;
— болюсное введение 1 млн 500 тыс. ME в течение 10 мин;
— болюсное введение 1 млн 500 тыс. ME с последующей капельной инфузией 1 млн 500 тыс. ME в течение 30—60 мин;
— болюсное введение 3 млн ME в течение 10 мин.
Последние три схемы потенциально могут быть опасны повышенным риском кровотечений, в связи с чем должны применяться только у больных с кардиогенным шоком или резистентным к стандартной терапии отеком легких при невозможности выполнить экстренную коронарную баллонную ангиопластику.
Наш относительно небольшой опыт свидетельствует о том, что подобные схемы позволяют в ряде случаев предотвратить летальный исход у больных с кардиогенным шоком, при этом частота геморрагических осложнений не больше, чем при «стандартной» схеме введения.
Аллергические реакции на введение стрептокиназы отмечены у 1,7% больных (по данным ISIS-1, 1988).
Вероятность развития анафилактического шока в ответ на введение стрептокиназы невелика.
Предварительное (профилактическое) внутривенное введение гидрокортизона не предотвращает тяжелые аллергические реакции.
При анафилактическом шоке внутривенно вводят 200 мг гидрокортизона гемисукцината и 1 мг адреналина.
Урокиназу вводят внутривенно в дозе 2 млн ИЕ болюсом или же болюсом вводят 1,5 млн ИЕ и еще 1,5 млн ИЕ вводят капельно.
Высокой тромболитической активностью обладает тканевой активатор плазминогена (т-АП), выпускаемый под названиями алътеплаза, активаза и др.
Первоначально стандартная схема введения включала внутривенное введение 6—10 мг т-АП (болюс) с последующим капельным введением 50—54 мг (всего 60 мг за 1 ч) и дальнейшим введением 40 мг в течение 2 ч В 1996 г.
Европейское общество кардиологов рекомендовало ускоренное введение т-АП: 15 мг болюсом, далее в дозе 0,75 мг/кг в течение 30 мин и затем 0,5 мг/кг в течение не менее 60 мин (при общей дозе также не более 100 мг).
При назначении т-АП рекомендуется внутривенное введение гепарина в течение 48 ч. Следует помнить, как указывал В.И. Метелица (1996), что натриевая соль гепарина не совместима с т-АП.
Анистреплаза вводится внутривенно болюсом в дозе 300 ЕД в течение 2—5 мин.
Поскольку препарат содержит стрептокиназу, возможны аллергические реакции.
Следует ли сочетать тромболитические препараты с гепарином?
По-видимому, комбинация стрептокиназа — гепарин не имеет преимуществ перед введением одной стрептокиназы.
В то же время сочетание т-АП с гепарином улучшает ближайшие результаты тромболитической терапии.
В связи с риском ретромбоза после окончания введения тромболитика рекомендуется внутривенная инфузия гепарина в дозе 700—1200 ЕД/ч под контролем активированного частичного тромбопластинового времени (АЧТВ), которое должно быть в 1,5—2 раза больше нормальных значений.
При стабильном клиническом состоянии больного через 2—3 суток переводят на подкожное введение 12 тыс.—30 тыс. ЕД гепарина в сутки (обычно в 4 приема) под контролем АЧТВ с последующим постепенным снижением дозы в течение 3— 5 дней с последующей отменой.
Кроме того, можно применять низкомолекулярные гепарины, в частности фраксипарин по 15 тыс. ЕД в два приема.
Эти препараты не менее эффективны, чем внутривенно вводимый стандартный гепарин, реже вызывают кровотечения и не требуют лабораторного контроля.
Признаками восстановления коронарного кровотока и маркерами эффективного тромболизиса являются: исчезновение или существенное ослабление болевого синдрома, стабилизация гемодинамики при кардиогенном шоке, учащение или появление более сложных форм желудочковой аритмии, а также ускоренного узлового ритма.
Существуют также и ЭКГ-методы оценки эффективности тромболитической терапии. Достаточно простым и достаточно достоверным является оценка динамики сегмента ST на ЭКГ, которые регистрируются до и через 3 ч после начала введения тромболитика.
При этом оцениваются изменения ST либо в одном отведении с наибольшей элевацией, либо изменения суммарной элевации во всех отведениях, где она превышает 0,1 mV.
Если элевация ST в одном отведении или суммарная элевация ST уменьшается через 3 ч от начала введения тромболитика более чем на 50%, то это свидетельствует о восстановлении коронарного кровотока в инфарктсвязанной артерии.
Одновременно ускоряется вымывание из гибнущих клеток ферментов и миоглобина с быстрым увеличением их концентрации в крови.
Для оценки проходимости коронарной артерии используется принятая в исследовании TIMI (Trombolysis in Myocardial Infarction, 1985) классификация, согласно которой:
степень 0 — полная окклюзия «инфарктсвязанной» коронарной артерии;
степень I — незначительное прохождение контраста через место обструкции;
степень II — неполная перфузия дистального участка коронарного русла;
степень III — полное восстановление перфузии.
Ближайшая и отдаленная летальность при III-й степени проходимости артерии оказалась существенно ниже, чем при II-й степени.
При проведении тромболизиса необходимо как можно более раннее назначение дезагрегантов — аспирина 125—325 мг/сут. и/или тиклопидина (тиклида) в дозе 500 мг/сут., которые в последующем должны применяться длительно (по крайней мере не менее 1 года).
В случае развития ретромбоза, который проявляется, как правило, рецидивом тяжелого ангинозного приступа и реэлевацией сегмента ST в зоне инфаркта, необходимо повторное введение стрептокиназы по одной из вышеприведенных схем.
Эффективность повторного тромболизиса существенно возрастает при параллельной инфузии свежезамороженной плазмы (1—2 стандартные дозы).
В случаях когда ретромбоз развивается после 12—14 дней после первого введения стрептокиназы, лучше воспользоваться другим тромболитиком (предпочтительно рекомбинантным тканевым активатором плазминогена) в связи с резким нарастанием титра антител к стрептокиназе и развитием резистентности к препарату, а также повышенным риском аллергических осложнений.
Выбор тромболитического препарата не имеет принципиального значения.
Следует все же учитывать несколько большую опасность кровотечения при использовании т-АП, особенно в ускоренном варианте.
По данным метаанализа результатов нескольких исследований, геморрагические инсульты развивались у 0,54% пациентов, получивших стрептокиназу, и у 0,72% больных, леченных т-АП.
В то же время т-АП несколько чаще восстанавливает проходимость окклюзированной коронарной артерии.
Соответственно стрептокиназа предпочтительнее при артериальной гипертонии, а также у больных старше 75 лет (с большей вероятностью возникновения инсульта).
При отсутствии этих неблагоприятных факторов, особенно при обширных передних инфарктах миокарда (когда нужен препарат с максимальной эффективностью), в первые 2—4 ч (наибольшая вероятность быстро ограничить зону некроза) — преимущество остается за т-АП.
Тканевой активатор плазминогена должен вводиться также больным, получавшим в прошлом (в предыдущие 12 мес.) стрептокиназу или APSAC из-за наличия у них антител к стрептокиназе.
Реперфузионный синдром сопровождается ускоренной гибелью нежизнеспособных клеток, в зоне некроза могут возникнуть очаги геморрагии, в отдельных участках кровоток не восстанавливается вследствие необратимого повреждения микроциркуляторного звена в бассейне окклюзированной артерии.
Реперфузионные аритмии (практически никогда не приводящие к тяжелым последствиям) столь часты, что могут рассматриваться в качестве одного из маркеров реканализации коронарной артерии.
Успешная реперфузия миокарда почти в 90% случаев сопровождается желудочковыми нарушениями ритма.
Чаще всего возникают поздние желудочковые экстрасистолы и ускоренный идиовентрикулярный ритм.
Сравнительно редким осложнением эффективной реперфузии является фибрилляция желудочков.
Обычно реперфузионные аритмии не ухудшают состояния больного кратковременно и не требуют применения антиаритмиков.
Для предупреждения реперфузионных аритмий может оказаться эффективным магния сульфат.
Катион магния является кофактором более чем 300 внутриклеточных энзиматических процессов.
Главные предпосылки для введения магния в ранние сроки после возникновения инфаркта миокарда основаны на следующем:
— дефицит магния может способствовать развитию тяжелых желудочковых аритмий;
— гипомагниемия может способствовать перегрузке поврежденных (ишемизированных) миоцитов кальцием и натрием, в частности при реперфузии;
— устранение гипомагниемии ведет одновременно к устранению внутриклеточного дефицита калия и фосфатов.
В ряде исследований внутривенное введение магния в первые часы инфаркта миокарда (в том числе сразу после тромболизиса) снижало риск летального исхода на 24—45%.
Одно из исследований (IMIT-2) продемонстрировало 20% снижение летальности в отдаленные сроки — в среднем до 4,5 лет — после инфаркта миокарда.
Вместе с тем в ISIS-4 (58 050 больных) эффект не был получен: 35-дневная летальность не снижалась при введении магния; возможные причины этого расхождения — подбор больных, сочетание с широким применением ацетилсалициловой кислоты и тромболизиса, особенности сроков введения магния.
Учитывая относительно редкие побочные эффекты (угнетение дыхания) и широкую доступность препарата, магния сульфат можно вводить в первые часы инфаркта миокарда в вену в виде 20% раствора (в 5 мл — 8,1 мэкв магния).
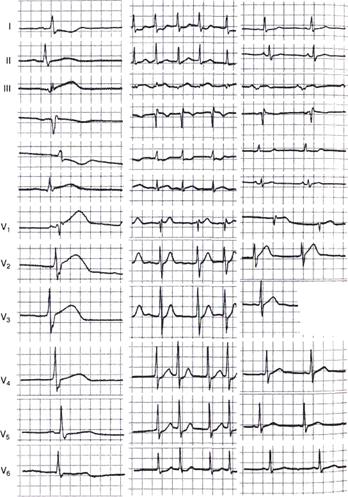
Рис. 39. Динамика ЭКГ при введении стрептодеказы. Объяснения в тексте
Если есть возможность определять уровень магния в крови, следует добиться, чтобы он был не ниже 2,0 мэкв/л. Особенно важно избежать дефицита магния у больных с гипокалиемией (менее 4,0 мэкв/л).
Реперфузионные аритмии связывают, в частности, с повышенным вхождением кальция в поврежденные миоциты после восстановления проходимости коронарной артерии.
Больной 59 лет поступил в клинику через 3 ч после начала тяжелого ангинозного приступа, сопровождавшегося подъемом сегмента ST в отведениях II, III, aVF, V1—V4 (рис. 39, а).
Врачом специализированной бригады скорой медицинской помощи состояние расценено как инфаркт миокарда, начато внутривенное введение стрептодеказы в дозе 3 млн ЕД.
В период введения препарата у больного развилась фибрилляция желудочков, устраненная разрядом дефибриллятора.
На последующих электрокардиограммах отмечена выраженная положительная динамика (рис. 39, б, в); инфаркт миокарда локализовался в области нижней стенки левого желудочка.
Этому больному не проводили коронарографический контроль, однако динамика ЭКГ и характерное для успешной реперфузии миокарда возникновение фибрилляции желудочков в период тромболитической терапии свидетельствуют об в эффективности.
Наличие некроза миокарда подтверждалось значительной гиперферментемией.
При проведении фибринолитической терапии в первые часы развития инфаркта миокарда восстановление коронарной перфузии происходит, по данным различных авторов, у 60—90% больных; если терапия начата в сроки от 4 до 6 ч, ее эффективность значительно снижается.
В более поздние сроки (6—12 ч и позже) целесообразность введения стрептокиназы сомнительна. Все же, учитывая возможность наращивания тромба с соответствующим расширением очага некроза и перинекротической зоны, фибринолитическую терапию можно проводить, но в менее интенсивном режиме.
Введение стрептокиназы предпочтительно проводить под контролем лабораторных показателей.
Оптимальным является снижение уровня фибриногена крови в 2—3 раза по сравнению с исходным, увеличение тромбинового времени в 2—4 раза, подавление агрегации эритроцитов и тромбоцитов.
Лабораторный контроль желателен не реже чем через 1, 3, 5и24чот начала лечения.
Одновременно определяются число эритроцитов и уровень гемоглобина крови.
Стрептокиназа оказывает не только фибринолитическое, но антикоагулянтное и антиагрегантное действие, поэтому в первые сутки применения препарата гепарин может не добавляться.
Со вторых суток в связи с повышением коагулирующей способности крови и агрегационной активности эритроцитов и тромбоцитов назначается гепарин по 5000 ЕД 4 раза в сутки подкожно одновременно с ацетилсалициловой кислотой по 125—250 мг 2 раза в день.
Инъекции гепарина продолжаются около недели, препарат отменяется постепенно в течение 2—4 дней. Дозы аспирина через несколько дней уменьшают до 125—250 мг 1 раз в день.
В отличие от стрептокиназы проурокиназа и урокиназа являются прямыми активаторами плазминогена.
В литературе используется также термин «одно- и двухцепочечный активатор плазминогена урокиназного типа».
В действительности этот фермент не является киназой, как это ошибочно предположили вначале.
Урокиназа вводится внутривенно в дозе 4400 ЕД/кг в течение 10 минут, а затем длительно (12—24 ч и более — до 72 ч) в дозе 4400 ЕД/кг в течение каждого часа введения.
Инъекции гепарина назначают не ранее чем через 1 ч после прекращения введения урокиназы.
Показания и противопоказания для введения урокиназы и фибринолизина аналогичны таковым для стрептокиназы.
Введение стрептокиназы может сопровождаться рядом побочных действий: подъемом температуры тела вследствие реакции с содержащимися в крови противострептококковыми антителами (у 20—25% больных), уртикарной сыпью, отеком Квинке, бронхоспазмом, артериальной гипотонией, болями в поясничной области.
В отличие от стрептокиназы — фермента, продуцируемого штаммом β-гемолитического стрептококка группы С, урокиназа содержится в моче человека и не обладает антигенными свойствами (препарат получают из почек человеческого плода).
Кровотечения представляют реальную опасность при тромболитической терапии.
Их частота относительно мало зависит от выбранного препарата.
Большинство кровотечений (свыше 70%) возникает в местах пункции сосудов.
По сводной статистике нескольких кооперативных исследований, частота внутричерепных кровотечений составила 0,75%; факторами риска являются возраст свыше 65 лет, масса тела менее 70 кг, наличие артериальной гипертензии и применение тканевого активатора плазминогена.
При их отсутствии вероятность внутричерепных кровотечений снижается до 0,26%, при наличии одного, двух и трех факторов риска она составляет соответственно 0,96, 1,32 и 2,17% [Van de Wert F., Betrik A. et al., 1988].
Следует отметить, что понятие «внутричерепное кровотечение» не идентично геморрагическому инсульту; число последних даже при использовании тканевого активатора плазминогена не превышает 3 на 1000 пациентов.
Отдельные подкожные геморрагии не являются основанием для прекращения тромболитической терапии.
При серьезных геморрагических осложнениях введение препаратов прекращается, внутривенно капельно вводится ингибитор фибринолиза е-аминокапроновая кислота — до 100 мл 5% раствора; может также быть проведено переливание свежезамороженной плазмы и крови.
Введение е-аминокапроновой кислоты можно повторять с промежутками в 4 ч.
Следует отметить, что геморрагические осложнения возникают без строгой зависимости от доз тромболитических препаратов и лабораторных показателей их эффективности.
Гепарины
Гепарин — антикоагулянт прямого действия, угнетающий факторы свертывания непосредственно в крови, вырабатывается тучными клетками (мастоцитами).
Препарат выделяют из легких крупного рогатого скота.
Гепарин обладает многообразным действием, выходящим за пределы собственно воздействия на коагуляцию: угнетает пролиферацию гладких мышц в сосудистой стенке, активирует липопротеинлипазу и обладает гиполипидемическим действием, снимает коронароспазм, вызванный питуитрином.
Гепарин способствует агглютинации тромбоцитов с парадоксальным формированием тромбов; у 20% больных гепарин вызывает тромбоцитопению.
Гепарин оказывает сильное антитромбиновое действие, он тормозит также образование тромбопластина и фибрина.
До появления тромболитиков гепарин был практически обязательным (при отсутствии противопоказаний) компонентом лечения острого инфаркта миокарда.
Было показано, что его применение снижает частоту рецидивирующего течения инфаркта миокарда, тромбозов глубоких вен, тромбоэмболии в системе легочной артерии, инсультов.
Хотя частота кровотечений у больных, получавших гепарин, увеличивалась в 2—4 раза, больничная летальность, по данным различных авторов, снижалась благодаря гепарину на 10—30%.
По нашему опыту, источником большинства кровотечений оказываются своевременно нераспознанные (плохо собранный анамнез, «немое» течение язвенной болезни желудка и двенадцатиперстной кишки) пептические язвы.
Современными исследованиями показана нецелесообразность применения гепарина при введении стрептокиназы и одновременном назначении ацетилсалициловой кислоты.
Напротив, при использовании тканевого активатора плазминогена рекомендуется сочетать его с гепарином.
Больным, вынужденным длительно оставаться в постели, для предупреждения тромбозов глубоких вен нижних конечностей показано подкожное введение гепарина (12 500 ЕД 2 раза в сут.).
Препарат вводится преимущественно внутривенно и подкожно; внутримышечные инъекции нежелательны из-за возможности возникновения болезненных кровоизлияний.
Лечение гепарином начинают с внутривенного введения 5 тыс.—10 тыс. ЕД, затем продолжается капельная инфузия со скоростью 1000 ЕД/ч или препарат вводят подкожно по 10 000 ЕД 2 раза в сут.
После введения гепарина в вену его антикоагулянтное действие сохраняется в течение 3—4 ч.
Обычное место для подкожных инъекций — жировая клетчатка нижней части живота. При лечении гепарином парциальное тромбопластиновое время должно быть увеличено в 1,5 раза по сравнению с исходным.
Можно ориентироваться и по времени свертывания крови.
Продолжительность гепаринотерапии при неосложненном инфаркте миокарда 5—7 дней. В период введения гепарина контролируют также содержание эритроцитов и гемоглобина крови, проводят повторные исследования кала на скрытую кровь и мочи на наличие микрогематурии.
Противопоказанием для гепаринотерапии при инфаркте миокарда являются геморрагические диатезы, болезни крови, высокая артериальная гипертония, опухолевые и язвенные поражения желудочно-кишечного тракта, тяжелые нарушения функции печени и почек.
Введение гепарина может приводить к кровотечениям различной локализации у 10—20% больных, причем у 1—5% развиваются тяжелые геморрагии даже в условиях контролируемой терапии, в частности ретроперитонеальные гематомы.
В качестве антагониста гепарина используют протамина сульфат, вводимый внутривенно струйно или капельно под контролем свертываемости крови. Если с момента введения гепарина прошло не более 15 мин, препарат применяют из расчета 10 —15 мг на 1000 ЕД гепарина. При большем сроке доза может быть уменьшена.
Обычно вводят внутривенно в течение 10 мин 50 мг препарата (до 200 мг в течение 2 ч).
В настоящее время при подкожном введении преимущество отдается низкомолекулярным гепаринам — одной из фракций стандартного гепарина.
В ряде исследований было показано их преимущество по сравнению с нефракционированным гепарином, в частности у больных с острым коронарным синдромом без подъема сегмента ST.
Низкомолекулярные гепарины в большей степени подавляют образование тромбина, реже вызывают тромбоцитопению, обладают большей биодоступностью, что позволяет ограничиваться двумя инъекциями в сутки.
Низкомолекулярные гепарины в меньшей степени связываются с белками плазмы и соответственно, оказывают более постоянный антикоагулянтный эффект.
При их применении нет необходимости в контроле частичного тромбопластинового времени. Однако, низкомолекулярные гепарины могут влиять на функцию почек, и их доза должна уменьшаться при клиренсе креатинина менее 30 мл/мин.








