Вопросы для подготовки к занятию
1. Дисперсные системы. Истинные и коллоидные растворы.
2. Растворимость веществ, факторы, влияющие на растворимость (температура, природа вещества, природа растворителя).
3. Способы выражения концентрации растворов: массовая доля растворенного вещества в растворе, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, титр, мольная доля, объемная доля.
4. Принцип титриметрического анализа. Расчеты в титриметрии.
Важнейшей характеристикой количественного содержания компонентов в системе является концентрация растворов.
Концентрацией растворов называют определенное массовое (или объемное) содержание растворенного вещества в определенном массовом (или объемном) количестве растворителя или раствора.
Существуют несколько методов выражения концентрации растворов. Рассмотрим самые распространенные из них
| Методы выражения концентрации растворов
| Обозначение и размерность применяемых величин
|
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора:

|  - массовая доля растворенного вещества, безразмерная величина - массовая доля растворенного вещества, безразмерная величина
|
| mВ - масса растворенного вещества, г
|
| mР-РА - масса раствора, г
|
| V - объем раствора, мл
|
| ρ -плотность раствора, г/мл
|
Процентная концентрация:
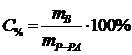
| С% - процентная концентрация, %
|
| m В - масса растворенного вещества, г
|
| mР-РА - масса раствора, г
|
Молярная концентрация, или молярность, – число молей растворенного вещества в 1 дм3
(1 литр) раствора:
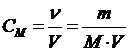
| СМ - молярная концентрация, или молярность; иногда обозначают М
|
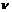 - количество (число моль) растворенного вещества, моль - количество (число моль) растворенного вещества, моль
|
| V - объем раствора, дм3 (л)
|
| mВ - масса растворенного вещества, г
|
| МВ - молярная масса растворенного вещества, г/моль
|
Для более рационального решения предложенных задач можно применять вспомогательные формулы
| Формула
| Применение
|
| mР-РА = V · ρ
| Для вычисления массы раствора
|

| Для воды  при 4 оС (1мл = 1 см3) при 4 оС (1мл = 1 см3)
|

| Для перехода от процентной к молярной концентрации
|

| Для перехода от молярной к процентной концентрации
|

| Для нахождения количества вещества
|
| m1Р-РА+ m2Р-РА= mР-РА
| При сливании двух растворов различных концентраций массы первого и второго растворов складываются
|
| m1В+ m2В= mВ
| При сливании двух растворов различных концентраций массы растворенных веществ, содержащихся в растворах, складываются
|
| m1В= m2В
| При разбавлении растворов водой масса вещества, содержащегося в растворе, остается неизменной
|
При решении задач необходимо обращать особое внимание на размерность применяемых величин и обязательно приводить их в соответствие друг другу. Поэтому при подстановке численных значений в формулы надо указывать размерность величин.
Упражнения
1. К 500 мл раствора соляной кислоты (ρ = 1,10 г/мл) прибавили 2,5 л воды, после чего раствор стал 4%-ным. Определите процентное содержание растворенного вещества в исходном растворе.
2. Определите молярную концентрацию раствора сульфата калия, в 200 мл которого содержится 1,74 г растворенного вещества.
3. Определите молярную концентрацию 10%-ного раствора серной кислоты (ρ = 1,07 г/мл).
4. До какого объема следует разбавить 1,5 л 20%-ного раствора хлорида аммония (ρ = 1,06 г/мл), чтобы получить 10%-ный раствор (ρ = 1,03 г/мл)?
5. Cколько миллилитров 36%-ного раствора соляной кислоты (ρ = 1,18 г/мл) требуется для приготовления 4 л 0,5 М раствора?
6. Сколько миллилитров воды следует прибавить к 25 мл 40%-ного раствора KOH (ρ =1,40 г/мл), чтобы получить 2%-ный раствор? а) Определите процентное содержание растворенного вещества в 0,25 М растворе гидроксида натрия (ρ = 1,01 г/мл). б) Сколько миллилитров 0,1 М раствора HCl можно приготовить из 20 мл 0,5 М раствора этой кислоты?
7. Определите нормальность 65%-ной азотной кислоты с плотностью 1,44 г/мл.
8. На титрование 20 мл раствора соды Na2СО3, приготовленного растворением 0,5356 г ее в мерной колбе на 100 мл, пошло 19,7 мл раствора соляной кислоты. Определить нормальность соляной кислоты.
9. Сколько мл 96 %-ной серной кислоты (ρ = 1,84 г/мл) нужно взять для приготовления 2 л 0,2 н. раствора?
10. К 550 мл 0,1925 М НС1 прибавили 50,00 мл раствора НС1 с титром 0,02370 г/мл. Вычислить молярную концентрацию и титр полученного раствора.
11. Какой объем раствора серной кислоты с массовой долей 9,3% (ρ = 1,105 г/см3) потребуется для приготовления 40 мл 0,35 М раствора H2SО4?
12. Какой объем хлороводородной кислоты (ρ = 1,19 г/мл) необходим для приготовления 1 л 0,1000 М раствора?
13. Для приготовления 500 мл раствора было взято 20,00 мл хлороводородной кислоты (ρ = 1,19 г/мл). Вычислить молярную концентрацию полученного раствора.




 - массовая доля растворенного вещества, безразмерная величина
- массовая доля растворенного вещества, безразмерная величина
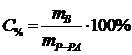
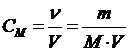
 - количество (число моль) растворенного вещества, моль
- количество (число моль) растворенного вещества, моль

 при 4 оС (1мл = 1 см3)
при 4 оС (1мл = 1 см3)






