Кино и телевидения
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ И ЭКОЛОГИИ
ОСНОВЫ МИКРОБИОЛОГИИ
И БИОТЕХНОЛОГИИ
Лабораторный практикум
САНКТ-ПЕТЕРБУРГ
УДК 628.543
Основы микробиологии и биотехнологии: Лабораторный практикум/Сост. Николаев А.Н., Большаков Н.Ю.; ГОУВПО СПбГУКиТ. СПб., 2010. 59 с.: ил.
В методических указаниях рассматриваются вопросы морфологии и физиологии простейших, закономерности роста клеток и способы их культивирования.
Методические указания предназначены для студентов для студентов специальности 280201 "Охрана окружающей среды и рациональное использование природных ресурсов".
Рецензент: доцент кафедры ТЦКМ СПбГТУРП, канд. техн. наук Лаптев В.Н.
Лабораторная работа № 1
ОСВОЕНИЕ ТЕХНИКИ МИКРОСКОПИРОВАНИЯ.
Задание.
1. Приготовить прижизненный препарат смешанной бактериально-дрожжевой культуры.
2. Выявить и зарисовать с указанием размеров основные и морфологические группы бактерий и дрожжевые клетки.
3. Оценить концентрацию бактерий и дрожжей.
Ход работы.
1. Приготовление прижизненного препарата.
На предварительно обезжиренное предметное стекло нанести пипетокй каплю микробной культуры (объем капли 0,05¸0,1 мл). Растекшаяся капля должна иметь диаметр около 1 см. Если капля не растекается, следует ее удалить и дополнительно обезжирить стекло (вымыть с мылом, протереть спиртом), в противном случае получится препарат, насыщенный пузырьками воздуха, что не позволит проводить микроскопирование.
Накрыть каплю покровным стеклом. Для получения хорошего препарата (без пузырьков воздуха) покровное стекло ставят под углом около 30 % на предметное стекло в сторону капли, пока не произойдет смачивание (рис. 1.4 б). После этого плавно опускают покровное стекло (см. рис. 1.4 в).

Рис. 1.4. Приготовление препарата (пояснения в тексте):
1 – покровное стекло; 2 – капля; 3 – предметное стекло
Если часть жидкости выдавливается из-под покровного стекла, то этот избыток аккуратно удаляют фильтровальной бумагой, не касаясь покровного стекла.
Приготовленный препарат размещается в центре предметного столика микроскопа и закрепляется зажимами.
2. Микроскопирование прижизненного препарата смешанной бактериально-дрожжевой культуры.
Настроить освещение, установить в рабочее положение объектив 8 (окуляр 15) и с помощью макрометрического винта добиться резкого изображения объекта (в виде точек видны дрожжевые клетки). Затем, повернув револьвер, поставить в рабочее положение объектив 40 и сфокусировать изображение микрометрическим винтом.
Передвигая предметный столик, просмотреть препарат, выявить и зарисовать различные формы бактерий и дрожжей. Размеры клеток определить визуально по масштабу: 1 мм (визуально) – 2 мкм.
3. Оценка концентраций бактерий и дрожжей.
Оценить среднее расстояние между дрожжевыми клетками ( ), и клетками бактерий (
), и клетками бактерий (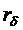 ), рассчитать концентрацию клеток по формулам:
), рассчитать концентрацию клеток по формулам:
 ;
; 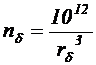 ,
,
где  – мкм;
– мкм; 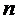 – 1/мл.
– 1/мл.
Для оценки концентрации микроорганизмов в единицах абсолютно сухого веса (а.с.в.) следует определить средний объем клеток бактерий и дрожжей. При этом дрожжевые клетки можно аппроксимировать сферой, диаметром  . Тогда объем дрожжевой капли:
. Тогда объем дрожжевой капли:
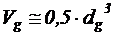 , мкм3.
, мкм3.
При плотности клетки  =0,1 г а.с.в./см3 масса дрожжевой клетки составит:
=0,1 г а.с.в./см3 масса дрожжевой клетки составит:
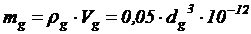 , г.
, г.
Концентрация дрожжевых клеток:
 , г а.с.в./л.
, г а.с.в./л.
Среднюю массу бактериальной клетки можно принять равной 4×10-13 г. Тогда концентрация бактерий:
 , г а.с.в./л.
, г а.с.в./л.
Общая концентрация микроорганизмов:
 .
.
Лабораторная работа № 2
Задание.
1. Приготовить и промикроскопировать прижизненный препарат активного ила, идентифицировав встречающихся микроскопических животных и зарисовав их с указанием размеров.
2. Зарисовать типичные хлопья активного ила, оценить средний размер хлопьев и их структуру (компактные, рыхлые).
Ход работы.
1. Собрать и настроить микроскоп. Приготовить прижизненный препарат активного ила. Просмотреть препарат при увеличении 120 (объектив 8, окуляр 15). Для идентификации простейших и других микроскопических животных использовать рис. 2.1-2.8 (идентификация проводится по внешнему виду). Перед переходом на увеличение 600 (объектив 40, окуляр 15) необходимо предварительно размещать исследуемый объект в центре поля зрения. Размер микроорганизмов определить визуально, исходя из масштаба, например при увеличении 600: 1 см (визуально) – 20 мкм.
2. Определение среднего размера хлопьев выполнить при увеличении 120, используя масштаб: 1 см (визуально) – 100 мкм. Структуру хлопьев установить при увеличении 600, зарисовав типичные хлопья.
Лабораторная работа №3
Рис. 3.2. Траектория движения по препарату в ходе микроскопирования с подсчетом простейших и коловраток
По мере движения по препарату необходимо подсчитывать количество микроорганизмов по группам, представленным в табл. 3.1 и фиксировать состояние микроорганизмов (см. табл. 3.2).
После завершения подсчета простейших и коловраток (во всем препарате) заполнить табл. 3.3, рассчитав количество микроорганизмов каждой группы по формуле:
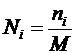 ,
,
| где
| 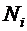 - количество микроорганизмов - количество микроорганизмов 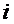 -й группы (амебы, жгутиковые и т.д.), тыс. шт./г активного ила; -й группы (амебы, жгутиковые и т.д.), тыс. шт./г активного ила;
|
|
|  - число микроорганизмов - число микроорганизмов  -й группы в препарате, найденное в ходе микроскопирования, шт.; -й группы в препарате, найденное в ходе микроскопирования, шт.;
|
|
| 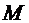 - количество ила в препарате, мг. - количество ила в препарате, мг.
|
Таблица 3.3
Задание.
1. Приготовить модельную сточную воду.
2. Снять кинетическую кривую потребления кислорода активным илом в системе «активный ил - модельная сточная вода».
3. Обработать экспериментальные данные и получить зависимость скорости потребления кислорода от его концентрации, а также значения константы Моно и критической концентрации растворенного кислорода.
Ход работы.
1. Приготовление модельной сточной воды.
Модельная сточная вода готовится по одному из трех вариантов (вариант задается преподавателем).
Вариант I. В 1 литре предварительно отстоянной и аэрированной водопроводной воды растворить 500 мг глюкозы (можно использовать сахарозу или ксилозу), 54 мг хлористого аммония (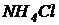 ) и 13 мг дигидрофосфата калия (
) и 13 мг дигидрофосфата калия (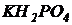 ). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении:
). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении:
БПК5:N:Р=100:4:1
Вариант II. Черный сульфатный щелок развести в 100 раз водопроводной водой и добавить биогенные соли (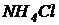 ,
, 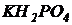 или
или 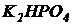 ) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.
) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.
Вариант III. Модельная сточная вода сульфитно-целлюлозного производства готовится разбавлением отработанного сульфитного щелока так же, как в варианте II, но для нейтрализации используется раствор едкого натра.
2. Получение кинетической кривой потребления кислорода активным илом.
Наиболее точно потребление кислорода измеряется оксиметрическим методом. Принцип метода состоит в следующем. Насыщенную кислородом сточную воду смешивают с активным илом и помещают в сосуд с мешалкой. Затем в сосуд помещают датчик анализатора кислорода (оксиметра) таким образом, чтоб обеспечить герметичность сосуда и полное отсутствие в нем воздуха. Включают перемешивание. В результате потребления кислорода микроорганизмами его концентрация падает. Концентрация кислорода непрерывно измеряется оксиметром и фиксируется на ленте самописца, где вычерчивается кинетическая кривая 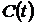 . Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.
. Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.
Рис. 4.3. Схема установки для измерения потребления кислорода активным илом:
1 – оксиметр (кислородомер); 2 – датчик оксиметра (кислородомера); 3 – рабочий сосуд с активным илом; 4 – ванна термостатирования; 5 – магнитная мешалка; 6 – перемешивающее устройство; 7 – лабораторный трансформатор (латр); 8 – самописец; 9 – термостат
При выполнении работы необходимо соблюдать определенную последовательность операций:
· Измерить объем жидкости (воды) в сосуде 3 при погруженном в него датчике 2. Для этого в сосуд наливают воду и опускают датчик так, чтобы часть воды вытеснилась из сосуда и вылилась в ванну 4. Затем датчик вынимают, а воду переливают в мерный цилиндр и измеряют ее объем (V).
· Рассчитать объем ила (Vи) и сточной воды (Vв) так, чтобы выполнялось:
Vи+Vв=V
Vв:Vи»4.
· Отобрать из лабораторного аэротенка иловую смесь объемом около 5 Vи и поместить ее в цилиндр для отстаивания. Когда объем, занимаемый осевшим илом, станет меньше Vи, слить сифоном надосадочную воду до отметки Vи. Активный ил объемом Vи из цилиндра перелить в сосуд 3 с перемешивающим устройством 6.
· Модельную сточную воду объемом Vв, предварительно насыщенную кислородом (аэрация в течение 5 мин. от микрокомпрессора), перелить в сосуд 3 с перемешивающим устройством 6.
· Опустить в сосуд с мешалкой датчик 2 оксиметра 1. Убедиться, что в сосуде отсутствуют пузырьки воздуха (могут прилипать к датчику), а жидкость занимает весь объем сосуда.
· Выставить на латре 7 напряжение U=150 В и включить магнитную мешалку 5. Убедиться, что обеспечивается хорошее перемешивание иловой смеси.
· Включить перо и ленту самописца 8. Убедиться, что показания оксиметра и самописца совпадают. Контролировать ход процесса, наблюдая за лентой самописца.
· Когда концентрация кислорода снизится до 5 мг/л, включить на оксиметре новый диапазон 0¸5 (исходное положение переключателя диапазонов оксиметра должно быть 0¸20). На диапазоне 0¸5 цена деления шкалы оксиметра составляет 0,2 мг/л, что позволяет производить визуальные измерения (по шкале оксиметра) более точно, чем отсчет по ленте самописца. Поэтому в момент, когда С=5,0 мг/л, включаем секундомер и снимаем показания по шкале оксиметра, занося результаты в таблицу (см. табл. 4.1).
Таблица 4.1
Результаты определения кинетики потребления кислорода
Активным илом
| t, сек.
|
|
|
|
|
|
|
| ...
|
|
|
| ...
|
| С, мг/л
| 5,0
| 4,8
| 4,6
| 4,4
| 4,2
| 4,0
| 3,8
| ...
| 2,0
| 1,9
| 1,8
| ...
|
Когда концентрация кислорода снизится до 2 мг/л, переходим на шкалу 0¸2, имеющую цену деления 0,1 мг/л. Продолжаем отсчет времени через каждые 0,1 мг/л (см. табл. 4.1), пока концентрация кислорода не достигнет нуля.
Рис. 4.4. Кинетика потребления кислорода
Таблица 4.2
Основные положения.
Температура водных микроорганизмов равна температуре окружающей среды, поэтому воздействие фактора температуры на клетки неизбежно. Температура влияет как на скорость биохимических реакций, так и на видовой состав биомассы в биореакторе.
В зависимости от температурного интервала роста и диапазона оптимальных температур бактерии делят на три основные группы (см. табл. 5.1 [1, с. 45]): психрофилы (любят низкие температуры), мезофилы (любят средние температуры) и термофилы (любят высокие температуры). Соответствующую терминологию используют и для обозначения температурного режима роста клеток, например «психрофильные условия», «термофильный режим», «биореактор мезофильного сбраживания» и т.д.
Таблица 5.1
Задание.
1. Экспериментально получить зависимость скорости потребления кислорода активным илом от температуры в процессе роста на сложном субстрате.
2. Выполнить расчет средних относительных ошибок уравнений (5.1), (5.2), (5.3) и выбрать уравнение, наиболее точно описывающее экспериментальные данные. Определить параметры выбранного уравнения.
Ход работы.
| 1.
| Из лабораторного аэротенка отобрать в цилиндр 1 л иловой смеси. После 10 минут отстаивания осевший активный ил (около 200 мл) перенести в колбу и при интенсивном перемешивании разделить на 5 равных частей (по 40 мл), каждую из которых поместить в колбы объемом 100 мл. В первой колбе постепенно довести температуру активного ила до 10°С, во второй – до 15°С, в третьей – до 20°С, в четвертой – до 25°С, в пятой – до 30°С. В процессе охлаждения (нагрева) активный ил необходимо периодически аэрировать (или перемешивать).
|
| 2.
| Приготовить питательную среду (0,5 л) путем разбавления в 100 раз отработанного сульфитного щелока с последующей его нейтрализацией (до рН=7¸8) и добавкой биогенных элементов из расчета БПК5:N:Р=100:5:1 (принять для полученной среды БПК5 =200 мг/л). Полученный раствор насытить кислородом (аэрация 10 минут от микрокомпрессора), а затем разделить на 5 частей (по 100 мл) и довести температуру, соответственно, до 10; 15; 20; 25 и 30°С.
|
| 3.
| Для измерения скорости потребления кислорода активным илом при различных температурах используется оксиметрическая установка (см. рис. 4.3). В окиметрическую ячейку последовательно вводится 30 мл активного ила и 70 мл питательной среды с той же температурой. В ячейку помещают датчик оксиметра, включают перемешивание и снимают динамику уменьшения концентрации кислорода. Скорость потребления кислорода рассчитывают графоаналитически по динамике уменьшения концентрации растворенного кислорода (строят график зависимости 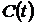 и находят величину максимальной скорости потребления кислорода).
Группа студентов (около 10 человек) делится на 5 бригад (по 2 человека). Каждая бригада определяет скорость потребления кислорода при одной заданной температуре.
Полученная зависимость скорости от температуры изображается в виде графика и находят величину максимальной скорости потребления кислорода).
Группа студентов (около 10 человек) делится на 5 бригад (по 2 человека). Каждая бригада определяет скорость потребления кислорода при одной заданной температуре.
Полученная зависимость скорости от температуры изображается в виде графика  . Если во всем температурном диапазоне скорость возрастает, то в дальнейших расчетах учитываются все пять экспериментальных точек. В противном случае отбор данных для дальнейших расчетов выполняется совместно с преподавателем. . Если во всем температурном диапазоне скорость возрастает, то в дальнейших расчетах учитываются все пять экспериментальных точек. В противном случае отбор данных для дальнейших расчетов выполняется совместно с преподавателем.
|
| 4.
| Полученные результаты обрабатываются, как описано выше. Выбирается уравнение (см. уравнения 5.1-5.3), дающее наименьшую относительную ошибку  . Для выбранного уравнения находятся входящие в него параметры. Выбранное уравнение приводится в окончательном виде (после подстановки значений параметров) с указанием абсолютной ошибки. . Для выбранного уравнения находятся входящие в него параметры. Выбранное уравнение приводится в окончательном виде (после подстановки значений параметров) с указанием абсолютной ошибки.
|
Лабораторная работа № 6
Задание.
1. Определить оксиметрически скорость эндогенного дыхания активного ила.
2. Приготовить модельную сточную воду и запустить аэробный реактор периодического культивирования активного ила.
3. Измерить оксиметрически скорость потребления кислорода в начале и в конце цикла периодического культивирования при различной интенсивности перемешивания.
4. Рассчитать параметры роста и определить лимитирующие рост факторы в начале и конце цикла периодического культивирования.
Ход работы.
1. Определение скорости эндогенного дыхания активного ила.
Из донорного лабораторного аэробного реактора отбираем 200 мл иловой смеси и отстаиваем в мерном цилиндре. Через 5-10 минут, когда объем осадка станет менее 80 мл, с помощью сифона сливаем надосадочную жидкость до отметки 80 мл. В цилиндр вводим аэратор и включаем аэрацию активного ила от микрокомпрессора. Измеряем температуру ила.
Через 5 минут, не отключая аэрацию, отбираем сифоном половину (40 мл) активного ила в сосуд с мешалкой установки для определения скорости потребления кислорода (см. лаб. раб. № 4). Затем приливаем в сосуд водопроводную воду до отметки, отвечающей рабочему объему сосуда с мешалкой. Водопроводная вода предварительно должна быть отстояна, насыщена кислородом и подогрета (охлаждена) до температуры активного ила.
Снимаем кинетику потребления кислорода при выходном напряжении латра  и находим скорость эндогенного дыхания
и находим скорость эндогенного дыхания  (см. лаб. раб. № 4). Результаты оформляем в виде таблицы и графика зависимости концентрации кислорода от времени с начала отсчета.
(см. лаб. раб. № 4). Результаты оформляем в виде таблицы и графика зависимости концентрации кислорода от времени с начала отсчета.
Рассчитываем удельную скорость эндогенного дыхания (мгО2/(г×ч) по формуле (5.1). Концентрацию активного ила в сосуде с мешалкой  (г/л) определяем по формуле (6.9):
(г/л) определяем по формуле (6.9):
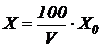 , (6.9)
, (6.9)
| где
|  – концентрация активного ила в донорном лабораторном реакторе (задается преподавателем), г/л; – концентрация активного ила в донорном лабораторном реакторе (задается преподавателем), г/л;
|
|
| 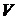 – рабочий объем сосуда с мешалкой, используемого для определения скорости эндогенного дыхания, мл. – рабочий объем сосуда с мешалкой, используемого для определения скорости эндогенного дыхания, мл.
|
2. Приготовление модельной сточной воды и запуск аэробного реактора периодического культивирования.
Модельная сточная вода готовится по одному из трех вариантов (см. лаб. раб. № 4), задаваемых преподавателем. После приготовления модельной воды ее температуру необходимо довести до температуры активного ила, а затем проаэрировать в течение 5 минут для насыщения кислородом.
Оставшиеся в мерном цилиндре 40 мл активного ила переливаем в сосуд с мешалкой. Затем добавляем в него модельную сточную воду до отметки, отвечающей рабочему объему сосуда, опускаем в сосуд датчик оксиметра, включаем магнитную мешалку при выходном напряжении латра 150 В и снимаем кинетику потребления кислорода (результаты фиксируем на самописце и путем прямого отсчета – см. лаб. раб. № 4).
Число оборотов магнитной мешалки ( ) в зависимости от выходного напряжения латра (
) в зависимости от выходного напряжения латра ( ) находим по калибровочному графику (размещен на оксиметрической установке) или по табл. 6.1.
) находим по калибровочному графику (размещен на оксиметрической установке) или по табл. 6.1.
Таблица 6.1
Интенсивности перемешивания
| t, с
|
|
| …
|
|
| …
|
| С, мг/л
|
|
| …
| 4,0
|
| …
|
 , мин-1 , мин-1
|
|
|
Данные табл. 6.2 иллюстрируем графиком зависимости 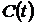 , по которому находим скорость потребления кислорода и критическую концентрацию растворенного кислорода. Пример графика и расчетов приведен на рис. 6.1.
, по которому находим скорость потребления кислорода и критическую концентрацию растворенного кислорода. Пример графика и расчетов приведен на рис. 6.1.

 С, мг/л
С, мг/л
Рис. 6.1. Кинетика потребления кислорода (с примером расчета скорости потребления кислорода и определения его критической концентрации)
Когда скорость потребления кислорода в сосуде с мешалкой начнет падать, измерения прекращаем, вынимаем датчик оксиметра, опускаем в сосуд аэратор и включаем аэрацию. Аэрацию продолжаем до конца цикла периодического культивирования (задается преподавателем).
В конце цикла периодического культивирования вновь проводим определение скорости потребления кислорода при двух уровнях перемешивания и находим критическую концентрацию кислорода.
Удельную скорость потребления кислорода рассчитываем по формуле (6.2), где концентрация ила в сосуде с мешалкой определяется по зависимости (6.9).
3. Расчет параметров роста и определение лимитирующих рост факторов в начале и конце цикла периодического культивирования.
Параметры роста находим по формулам (6.3)–(6.8) при  =170 мин-1 (выходное напряжение латра 150 В). Результаты свлдим в таблицу 6.3.
=170 мин-1 (выходное напряжение латра 150 В). Результаты свлдим в таблицу 6.3.
Таблица 6.3
Рис. 7.1. Принципиальная схема биологической очистки в аэротенке-смесителе
Введем следующие обозначения:  – расход сточной воды, м3/ч;
– расход сточной воды, м3/ч;  – расход иловой смеси, поступающей в отстойник, м3/ч;
– расход иловой смеси, поступающей в отстойник, м3/ч;  - концентрация ила в потоке
- концентрация ила в потоке  (такая же концентрация ила в аэротенке-смесителе), г/л;
(такая же концентрация ила в аэротенке-смесителе), г/л; 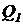 – расход очищенной воды, м3/ч;
– расход очищенной воды, м3/ч; 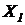 - концентрация активного ила в очищенной воде (вынос ила из системы биологической очистки), г/л;
- концентрация активного ила в очищенной воде (вынос ила из системы биологической очистки), г/л; 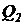 – расход избыточного ила, м3/ч;
– расход избыточного ила, м3/ч;  - - концентрация избыточного ила, г/л;
- - концентрация избыточного ила, г/л;  – расход возвратного ила, м3/ч.
– расход возвратного ила, м3/ч.
Для схемы (7.1) в стационарном режиме прирост активного ила равен:
 .
.
Так как 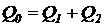 ,
,  , то выполняется:
, то выполняется: 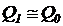 . Откуда следует:
. Откуда следует:
 . (7.3)
. (7.3)
В соответствии с соотношением (7.2) для стационарного режима получим:
 . (7.4)
. (7.4)
Если соотношение (7.4) не выполняется, то процесс культивирования (процесс биологической очистки) осуществляется не в стационарном, а в переходном режиме. При этом возможны два варианта:
а) 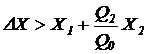 ;
;
(7.5)
б) 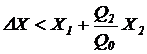 .
.
В варианте а) будет происходить увеличение концентрации активного ила в аэротенке, так как прирост ила превосходит его вывод из системы биологической очистки. В конечном итоге это вызовет увеличение выноса ила 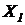 , и система перейдет в стационарное состояние (т.е. будут выполняться соотношения (7.3) и (7.4).
, и система перейдет в стационарное состояние (т.е. будут выполняться соотношения (7.3) и (7.4).
В варианте б) переходной режим закончится полным вымыванием активного ила из системы биологической очистки (биоочистка прекратится). Такой нежелательный исход может наступить даже при 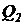 =0 (избыточный ил не выводится), если справедливо неравенство:
=0 (избыточный ил не выводится), если справедливо неравенство:
 <
< 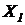 . (7.6)
. (7.6)
Выполнение неравенства (7.6) неизбежно приводит к нарушению биологической очистки вследствие вымывания активного ила из системы.
Задание
1. Запустить установку непрерывного культивирования, работающую по принципу хемостата с возвратом биомассы.
2. Определить скорость разбавления, концентрацию активного ила в реакторе и его вынос из системы непрерывного культивирования.
3. Определить удельную скорость роста активного ила и его прирост.
4. Сделать вывод о том, в каком режиме (стационарном, переходном) протекает процесс. Если процесс переходный, то оценить его последствия и выдать рекомендации по переводу системы в стационарный режим работы.
Ход работы.
1. Запуск установки, работающей по принципу хемостата с возвратом биомассы.
Приготовить 5 л модельной сточной воды (см. лаб. раб. № 4) и собрать схему, приведенную на рис. 7.2.

Рис. 7.2. Схема установи непрерывного культивирования активного ила (хемостат с возвратом биомассы):
1 – бутыль для приема выходного потока; 2 – биореактор; 3 – зона отстаивания; 4 – зона аэрации; 5 – аэратор; 6 – микрокомпрессор; 7 – перистальтический насос; 8 – бутыль с модельной сточной водой
Биореактор заполнить иловой смесью из донорной лабораторной установки, одновременно измерив его объем  .
.
После осаждения активного ила в зоне 3 включить микрокомпрессор 6, обеспечив подачу воздуха через аэратор 5 в зону аэрации 4 биореактора. Убедиться, что в зоне отстаивания 3 перемешивание отсутствует (активный ил из зоны 4 не выносится турбулентными потоками в зону 3).
Установить на перистальтическом насосе 7 расход около 15 л/сут, включить насос с подачей модельной сточной воды в зону аэрации биореактора. Убедиться, что активный ил из зоны отстаивания «вываливается» в зону аэрации и взмучивания ила в зоне отстаивания не происходит.
2. Определение скорости разбавления, концентрации ила и его выноса из биореактора.
Измерить геометрические размеры и рассчитать объем зоны отстаивания. Найти рабочий объем зоны аэрации 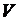 , л:
, л:
 .
.
Определить время 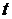 (час), за которое из реактора вытечет 500 мл воды, и рассчитать расход
(час), за которое из реактора вытечет 500 мл воды, и рассчитать расход  , л/ч:
, л/ч:
 .
.
По формуле (7.1) найти скорость разбавления 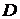 .
.
Из бутыли 1 отобрать 500 мл воды и определить концентрацию активного ила (вынос активного ила из биореактора).
Стандартный анализ концентрации активного ила требует около 6 часов и включает следующие операции: фильтрование пробы через фильтр с синей лентой, перенос фильтра с осадком в бюкс и высушивание в сушильном шкафу в течение 5 часов при температуре 105°С; охлаждение бюкса с фильтром в эксикаторе (около 0,5 часа), взвешивание на аналитических весах и расчет веса сухого активного ила (из веса бюкса с фильтром и высушенным илом вычитается вес бюкса с фильтром), расчет концентрации ила (вес ила делится на объем пробы). Указанная процедура не укладывается в период времени, отводимый для выполнения лабораторной работы.
Поэтому концентрацию активного ила находим путем экспресс-определения ХПК ила. С этой целью предварительно концентрируем активный ил не менее чем в 10 раз, либо центрифугированием (при 5 тыс. об/мин в течение 5-10 минут), либо отстаиванием (в случае хорошего осаждения ила). В результате из 500 мл пробы получаем 10-50 мл иловой смеси. От 3 до 6 мл иловой смеси используем для экспресс-анализа ХПК (длительность анализа около 10 мин.). Остальную иловую смесь фильтруем и тем же методом определяем ХПК фильтрата. Описание установки и методик экспресс-анализа ХПК приведены в отдельной инструкции.
Концентрацию активного ила (вынос ила из биореактора) рассчитываем по формуле (мг/л):
 ,
,
где  – отношение объема иловой смеси
– отношение объема иловой смеси 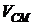 , полученной после концентрирования ила, к исходному объему пробы
, полученной после концентрирования ила, к исходному объему пробы  (
( =500 мл);
=500 мл);  - кислородный эквивалент (удельное ХПК) активного ила,
- кислородный эквивалент (удельное ХПК) активного ила,  =1,33 гХПК/г;
=1,33 гХПК/г;  ,
,  – найденные экспресс-методом значения ХПК для иловой смеси и фильтрата, мг/л.
– найденные экспресс-методом значения ХПК для иловой смеси и фильтрата, мг/л.
Для определения концентрации ила в зоне аэрации биореактора отбираем пробу объемом 12-15 мл. Половину пробы используем для определения ХПК иловой смеси. Остальную часть пробы фильтруем и находим ХПК фильтрата. Концентрацию ила рассчитываем по формуле:
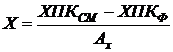 .
.
3. Определение удельной скорости роста активного ила и его прироста в биореакторе.
Из зоны аэрации биореактора отбираем пробу иловой смеси в сосуд с мешалкой и на оксиметрической установке находим скорость потребления кислорода (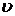 ) - см. лаб. раб. №4.
) - см. лаб. раб. №4.
Параллельно отбираем такой же объем иловой смеси в мерный цилиндр, отстаиваем в течение 15-30 минут, сливаем сифоном надосадочную воду и добавляем дистиллированную воду до исходного объема. Затем полученную иловую смесь аэрируем в течение 3-5 минут, переносим в сосуд с мешалкой и на оксиметрической установке определяем скорость потребления кислорода (скорость эндогенного дыхания ила  ).
).
Расчет удельной скорости роста активного ила  и прироста ила
и прироста ила  производим по формулам:
производим по формулам:
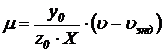 ;
;
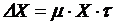 ;
;
 ,
,
где  =0,45;
=0,45;  =0,4; размерность параметров:
=0,4; размерность параметров:  - час-1;
- час-1;  – мг/л;
– мг/л;  ,
,  - мг/(л×час);
- мг/(л×час); 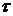 - час;
- час;  – мг/л.
– мг/л.
4. Анализ результатов и заключение о характере режима процесса непрерывного культивирования.
Проверяем, выполняется ли уравнение (7.4). Если с точностью до 10¸20 % условие (7.4) соблюдается, то хемостат работает в стационарном режиме. В противном случае имеет место переходной режим.
Для переходного режима проверяем, какое из неравенств (7.5) выполняется (принимаем 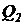 =0). Анализируем последствия переходного режима.
=0). Анализируем последствия переходного режима.
Для варианта (7.5а) находим по формуле (7.3) расход избыточного ила 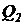 , необходимый для перевода хемостата в стационарный режим работы, принимая
, необходимый для перевода хемостата в стационарный режим работы, принимая  =
=  (т.е. полагая, что избыточный ил выводится из зоны аэрации биореактора).
(т.е. полагая, что избыточный ил выводится из зоны аэрации биореактора).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
| 1.
| Николаев А.Н., Нилова И.В. Основы микробиологии и биотехнологии: Учебное пособие/СПбГТУРП. СПб., 2002. – 111 с.
|
| 2.
| Хенце М. Очистка сточных вод. Биологические и химические процессы/ Пер. с англ. - М.: Мир, 2004. – 480 с.
|
| 3.
| Чернобережский Ю.М., Николаев А.Н., Вольф И.В. Основы микробиологии и химии воды: Учебное пособие/ЛТА. Л., 1988. – 83 с.
|
С О Д Е Р Ж А Н И Е
| Лабораторная работа № 1
|
|
| ОСВОЕНИЕ ТЕХНИКИ МИКРОСКОПИРОВАНИЯ
|
| МОРФОЛОГИЯ БАКТЕРИЙ И ДРОЖЖЕЙ……………………...……...............……3
|
| Лабораторная работа № 2
|
|
| МИКРОФАУНА И СТРУКТУРА ХЛОПЬЕВ АКТИВНОГО ИЛА…………………..9
|
| Лабораторная работа № 3
|
|
| БИОЛОГИЧЕСКИЙ АНАЛИЗ АКТИВНОГО ИЛА…………………………………18
|
| Лабораторная работа № 4
|
|
| ИССЛЕДОВАНИЕ ВЛИЯНИЯ КОНЦЕНТРАЦИИ РАСТВОРЕННОГО
|
|
| КИСЛОРОДА НА СКОРОСТЬ РОСТА МИКРООРГАНИЗМОВ…………………..27
|
| Лабораторная работа № 5
|
| ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА СКОРОСТЬ
|
|
| РОСТА МИКРООРГАНИЗМОВ…………………………………………………..…..36
|
| Лабораторная работа № 6
|
|
| ПЕРИОДИЧЕСКОЕ КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ.
|
|
| МОДЕЛИРОВАНИЕ АЭРОТЕНКОВ-ВЫТЕСНИТЕЛЕЙ…………………………..43
|
| Лабораторная работа № 7
|
|
| НЕПРЕРЫВНОЕ КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ.
|
|
| МОДЕЛИРОВАНИЕ АЭРОТЕНКОВ-СМЕСИТЕЛЕЙ………………….…………..51
|
| БИБЛИОГРАФИЧЕСКИЙ СПИСОК…………………………………………………58
|
| Николаев Алексей Николаевич
|
| Большаков Николай Юрьевич
|
| ОСНОВЫ МИКРОБИОЛОГИИ
И БИОТЕХНОЛОГИИ
|
| Лабораторный практикум
|
| Редактор и корректор Т.А. Смирнова
|
| Техн. редактор Л.Я. Титова
|
| Подп. к печати 22.09.08. Формат 60´84/16. Бумага тип №1. Печать офсетная.
|
| Объем 4,75 печ. л.; 4,75 уч.-изд. л. Тираж 300 экз. Изд. №104. Цена «С»104. Заказ
|
|
|
|
|
|
|
|
| | | |

Кино и телевидения
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ И ЭКОЛОГИИ
ОСНОВЫ МИКРОБИОЛОГИИ
И БИОТЕХНОЛОГИИ
Лабораторный практикум
САНКТ-ПЕТЕРБУРГ
УДК 628.543
Основы микробиологии и биотехнологии: Лабораторный практикум/Сост. Николаев А.Н., Большаков Н.Ю.; ГОУВПО СПбГУКиТ. СПб., 2010. 59 с.: ил.
В методических указаниях рассматриваются вопросы морфологии и физиологии простейших, закономерности роста клеток и способы их культивирования.
Методические указания предназначены для студентов для студентов специальности 280201 "Охрана окружающей





 ), и клетками бактерий (
), и клетками бактерий (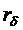 ), рассчитать концентрацию клеток по формулам:
), рассчитать концентрацию клеток по формулам: ;
; 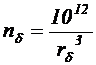 ,
, – мкм;
– мкм; 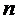 – 1/мл.
– 1/мл. . Тогда объем дрожжевой капли:
. Тогда объем дрожжевой капли: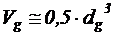 , мкм3.
, мкм3. =0,1 г а.с.в./см3 масса дрожжевой клетки составит:
=0,1 г а.с.в./см3 масса дрожжевой клетки составит: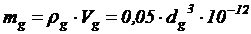 , г.
, г. , г а.с.в./л.
, г а.с.в./л. , г а.с.в./л.
, г а.с.в./л. .
.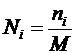 ,
,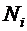 - количество микроорганизмов
- количество микроорганизмов 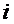 -й группы (амебы, жгутиковые и т.д.), тыс. шт./г активного ила;
-й группы (амебы, жгутиковые и т.д.), тыс. шт./г активного ила;
 - число микроорганизмов
- число микроорганизмов  -й группы в препарате, найденное в ходе микроскопирования, шт.;
-й группы в препарате, найденное в ходе микроскопирования, шт.;
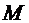 - количество ила в препарате, мг.
- количество ила в препарате, мг.
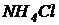 ) и 13 мг дигидрофосфата калия (
) и 13 мг дигидрофосфата калия (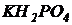 ). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении:
). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении: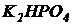 ) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.
) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.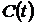 . Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.
. Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.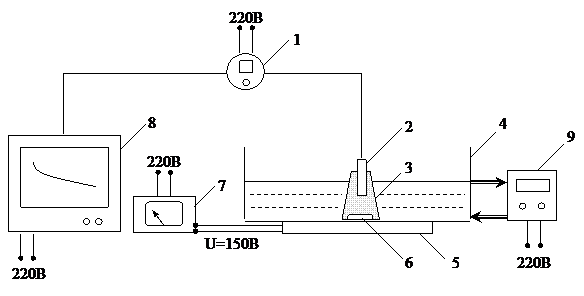
 . Если во всем температурном диапазоне скорость возрастает, то в дальнейших расчетах учитываются все пять экспериментальных точек. В противном случае отбор данных для дальнейших расчетов выполняется совместно с преподавателем.
. Если во всем температурном диапазоне скорость возрастает, то в дальнейших расчетах учитываются все пять экспериментальных точек. В противном случае отбор данных для дальнейших расчетов выполняется совместно с преподавателем.
 . Для выбранного уравнения находятся входящие в него параметры. Выбранное уравнение приводится в окончательном виде (после подстановки значений параметров) с указанием абсолютной ошибки.
. Для выбранного уравнения находятся входящие в него параметры. Выбранное уравнение приводится в окончательном виде (после подстановки значений параметров) с указанием абсолютной ошибки.
 и находим скорость эндогенного дыхания
и находим скорость эндогенного дыхания  (см. лаб. раб. № 4). Результаты оформляем в виде таблицы и графика зависимости концентрации кислорода от времени с начала отсчета.
(см. лаб. раб. № 4). Результаты оформляем в виде таблицы и графика зависимости концентрации кислорода от времени с начала отсчета. (г/л) определяем по формуле (6.9):
(г/л) определяем по формуле (6.9):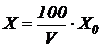 , (6.9)
, (6.9) – концентрация активного ила в донорном лабораторном реакторе (задается преподавателем), г/л;
– концентрация активного ила в донорном лабораторном реакторе (задается преподавателем), г/л;
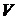 – рабочий объем сосуда с мешалкой, используемого для определения скорости эндогенного дыхания, мл.
– рабочий объем сосуда с мешалкой, используемого для определения скорости эндогенного дыхания, мл.
 ) в зависимости от выходного напряжения латра (
) в зависимости от выходного напряжения латра ( ) находим по калибровочному графику (размещен на оксиметрической установке) или по табл. 6.1.
) находим по калибровочному графику (размещен на оксиметрической установке) или по табл. 6.1.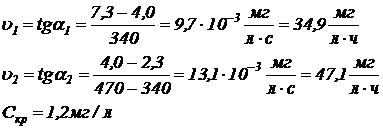

 С, мг/л
С, мг/л


 – расход сточной воды, м3/ч;
– расход сточной воды, м3/ч;  – расход иловой смеси, поступающей в отстойник, м3/ч;
– расход иловой смеси, поступающей в отстойник, м3/ч; 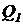 – расход очищенной воды, м3/ч;
– расход очищенной воды, м3/ч; 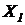 - концентрация активного ила в очищенной воде (вынос ила из системы биологической очистки), г/л;
- концентрация активного ила в очищенной воде (вынос ила из системы биологической очистки), г/л; 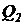 – расход избыточного ила, м3/ч;
– расход избыточного ила, м3/ч;  - - концентрация избыточного ила, г/л;
- - концентрация избыточного ила, г/л;  – расход возвратного ила, м3/ч.
– расход возвратного ила, м3/ч. .
.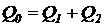 ,
,  , то выполняется:
, то выполняется: 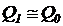 . Откуда следует:
. Откуда следует: . (7.3)
. (7.3) . (7.4)
. (7.4)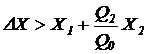 ;
;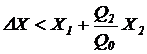 .
. <
< 

 .
.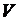 , л:
, л: .
.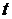 (час), за которое из реактора вытечет 500 мл воды, и рассчитать расход
(час), за которое из реактора вытечет 500 мл воды, и рассчитать расход  .
.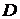 .
. ,
, – отношение объема иловой смеси
– отношение объема иловой смеси 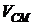 , полученной после концентрирования ила, к исходному объему пробы
, полученной после концентрирования ила, к исходному объему пробы  (
( - кислородный эквивалент (удельное ХПК) активного ила,
- кислородный эквивалент (удельное ХПК) активного ила,  ,
,  – найденные экспресс-методом значения ХПК для иловой смеси и фильтрата, мг/л.
– найденные экспресс-методом значения ХПК для иловой смеси и фильтрата, мг/л.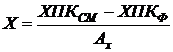 .
.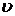 ) - см. лаб. раб. №4.
) - см. лаб. раб. №4. и прироста ила
и прироста ила 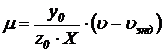 ;
;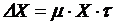 ;
; ,
, =0,45;
=0,45;  =0,4; размерность параметров:
=0,4; размерность параметров:  - час-1;
- час-1;  ,
, 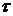 - час;
- час; 


