1.Цель работы: ознакомление с методами определения активной реакции среды, определение рН электрометрическим методом.
2.Теоретические сведения.
Активная реакция среды (рН), характеризующая степень ее кислотности или щелочности, определяется соотношением концентраций водородных и гидроксильных ионов.
Согласно классической теории электролитической диссоциации, произведение концентрации водородных и гидроксильных ионов представляет при определенной температуре постоянную величину – константу диссоциации:
[Н+] · [ОН-] = Кw, (при температуре 20° С Кw равна 10 -14 ).
Нейтральность воды и водных растворов характеризуется равенством концентраций водородных и гидроксильных ионов, следовательно, при [Н+] >10-7, [ОН-] <10-7 растворы имеют кислую реакцию, при [Н+]=[ОН-]=10-7 – нейтральную и при [Н+] <10-7, [ОН-] >10-7 – щелочную реакцию.
Согласно предложению Серенсена, активную реакцию среды выражают водородным показателем рН, представляющим собой отрицательный десятичный логарифм концентрации водородных ионов:
 ,
,
В соответствии с этим в кислых растворах  , в нейтральных
, в нейтральных  , в щелочных
, в щелочных 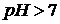 .
.
Для большинства природных пресных вод рН изменяется в пределах 6,5 - 8,5. На ее величину влияют повышенная концентрация в воде гуминовых кислот (например, в водах болотного характера, подверженных гидролизу солей), "цветение" водоемов, загрязнение их стоками промышленных предприятий и другие факторы.
Постоянство рН, от которого зависит протекание в воде различных биологических и физико-химических процессов, поддерживается в природных водах гидрокарбонатной буферной системой, состоящей из растворенной в воде угольной кислоты,  - и
- и  - ионов.
- ионов.
Активную реакцию воды чаще всего определяют колориметрическим или электрометрическим методом.
Колориметрический метод основан на изменении окраски индикатора в зависимости от концентрации ионов водорода.
Электрометрический метод определения рН основан на измерении разности потенциалов, возникающей на поверхности раздела между стеклянным электродом и раствором. Пределы линейной подчиненности потенциала электрода зависят от состава стекла электрода.
Стеклянный электрод применяют для измерения рН от 1 до 12,7. Он представляет собой трубку с напаянным на конце полым шариком из литиевого электродного стекла. При погружении электрода в раствор между поверхностью шарика и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода, и стеклянный электрод приобретает свойства водородного.
В качестве вспомогательного электрода сравнения рН используют проточный каломельный или хлорсеребряный электрод, корпус которого заполняется насыщенным раствором хлорида калия. Верхняя часть корпуса с отверстием для заливки хлорида калия закрывается резиновой пробкой, которая при измерениях вынимается.
Соединения железа, сероводорода, мышьяка, свободный хлор, взвешенные вещества и коллоиды на измерение концентрации ионов водорода в природных водах не влияют. Результат определения рН зависит от температуры воды.
3. Описание установки.
Для проведения лабораторной работы используются: лабораторный рН -метр (типа рН -150 или рН -340) со стеклянным электродом измерения и каломельным или хлорсеребряным электродом сравнения (рис.); реактивы: 1) буферный раствор с рН 1,68 при 20 °С: 12,710 г диоксалата калия  ч. д. а. растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 2) буферный раствор с рН 4 при 20 °С: 10,211 г дифталата калия
ч. д. а. растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 2) буферный раствор с рН 4 при 20 °С: 10,211 г дифталата калия  ч. д. а., высушенного при 110 °С, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 3) буферный раствор с рН 6,98 при 20 °С: 1,361 г
ч. д. а., высушенного при 110 °С, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 3) буферный раствор с рН 6,98 при 20 °С: 1,361 г  ч. д. а. и 1,420 г
ч. д. а. и 1,420 г 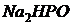 ч. д. а., высушенных при температуре 110-130 °С, растворяют одновременно в свежепрокипячснной и охлажденной дистиллированной воде и доводят объем при 20 °С до 1 л; 4) буферный раствор с рН 9,22 при 20 °С: 3,814 г
ч. д. а., высушенных при температуре 110-130 °С, растворяют одновременно в свежепрокипячснной и охлажденной дистиллированной воде и доводят объем при 20 °С до 1 л; 4) буферный раствор с рН 9,22 при 20 °С: 3,814 г  ч. д. а., сохраняемого продолжительное время в эксикаторе над бромидом натрия, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем при 20 °С до 1 л.
ч. д. а., сохраняемого продолжительное время в эксикаторе над бромидом натрия, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем при 20 °С до 1 л.
4. Порядок проведения работы.
4.1. Перед измерением рН проверяют прибор по стандартным буферным растворам.
4.2. Электроды промывают дистиллированной, затем исследуемой водой, после чего погружают в тщательно перемешанную исследуемую воду. Исследуют две пробы воды. Проба № 1 – водопроводная вода; проба №2 – вода после очистки ваграночных газов в мокром пылеуловителе.
4.3. С изменением температуры контролируемого раствора изменяются и характеристики электродной системы. В связи с этим применяют специальный автоматический термокомпенсатор или термометр, входящий в комплект лабораторного датчика ДЛ-02.
4.4. Величину потенциала стеклянного электрода отсчитывают в единицах рН, округляя результаты до 0,05-0,1. Результаты записывают в отчет.
5. Требования к отчету. Отчет должен содержать:
5.1. Цель работы и краткое изложение теории.
5.2. Порядок проведения работы и результаты опытов.
5.3. Анализ полученных результатов и вывод.
6. Контрольные вопросы.
6.1. Что такое "активная реакция среды"?
6.2. Что такое водородный показатель pH? Каковы его значения для кислых, нейтральных и щелочных растворов?
6.3. Какие методы применяются для определения активной реакции среды?
6.4. Какой метод использовался в работе, в чем его суть?
6.7. Какие приборы и материалы используются для определения pH?
6.8. Принцип работы прибора?
ЛИТЕРАТУРА
1. Андоньев М.С., Филипьев О.В. Пылегазовые выбросы предприятий черной металлургии. – М.: Металлургия, 1979, 192 с.
2. Глуховский В.И. Разработка системы очистки от высокодисперсных частиц пылегазовых выбросов плавильных агрегатов чугунолитейных цехов. – Автореф. Канд.дис. – Минск: БПИ, 1990, 17 с.
3. Гордон Г.М., Пейсахов И.Л. Контроль пылеулавливающих установок. – М.: Металлургия, 1973, 384 с.
4. Дубинская, Ф.Е., Белый О.А., Глуховский В.И. Газоочистное оборудование к чугунолитейным вагранкам. – Обзорн. информ. – М.:ЦИНТИХИМНЕФТЕМАШ, 1991, 40 с.
5. Перечень методик выполнения измерений, допущенных к применению в деятельности лабораторий экологического контроля предприятий и организаций Республики Беларусь. Т.1. – Минск.: НТЦ «АПИ», 1996, 208 с.
6. Расчет выбросов загрязняющих веществ в атмосферный воздух при горячей обработке металлов. Руководящий документ Республики Беларусь (РД 0212.3-2002), Минск, 2002, 156 с.
7. Ровин Л.Е. Защита воздушного бассейна от выбросов промышленных предприятий. – Обзорн. информ. – Минск: БелНИИНТИ, 1984, 55 с.
8. Сборник методик по расчету выбросов в атмосферу загрязняющих веществ различными производствами. – Ленинград: Гидрометиоиздат, 1986, 184 с.
9. Худокормов Д.Н., Белый О.А., Глуховский В.И., Дедовец В.А. Прогрессивные технологии очистки пылегазовых выбросов. – Обзорн. информ. – Минск: БелНИИНТИ, 1990, 43 с.
СОДЕРЖАНИЕ
Введение 3
1. Основные правила техники безопасности 3
2. Лабораторная работа № 1
Определение дисперсности пыли 4
3. Лабораторная работа № 2
Определенте скорости осаждения частиц 13
4. Лабораторная работа № 3
Исследование выделений оксида углерода при
термодеструкции связующих разных классов,
применяемых для изготовления форм и стержней 19
5. Лабораторная работа №;
Определение активной реакции среды 27
6. Литература 30





 ,
, , в нейтральных
, в нейтральных  , в щелочных
, в щелочных 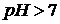 .
. - и
- и  - ионов.
- ионов. ч. д. а. растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 2) буферный раствор с рН 4 при 20 °С: 10,211 г дифталата калия
ч. д. а. растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 2) буферный раствор с рН 4 при 20 °С: 10,211 г дифталата калия  ч. д. а., высушенного при 110 °С, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 3) буферный раствор с рН 6,98 при 20 °С: 1,361 г
ч. д. а., высушенного при 110 °С, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем до 1 л; 3) буферный раствор с рН 6,98 при 20 °С: 1,361 г  ч. д. а. и 1,420 г
ч. д. а. и 1,420 г 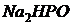 ч. д. а., высушенных при температуре 110-130 °С, растворяют одновременно в свежепрокипячснной и охлажденной дистиллированной воде и доводят объем при 20 °С до 1 л; 4) буферный раствор с рН 9,22 при 20 °С: 3,814 г
ч. д. а., высушенных при температуре 110-130 °С, растворяют одновременно в свежепрокипячснной и охлажденной дистиллированной воде и доводят объем при 20 °С до 1 л; 4) буферный раствор с рН 9,22 при 20 °С: 3,814 г  ч. д. а., сохраняемого продолжительное время в эксикаторе над бромидом натрия, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем при 20 °С до 1 л.
ч. д. а., сохраняемого продолжительное время в эксикаторе над бромидом натрия, растворяют в свежепрокипяченной и охлажденной дистиллированной воде при 20 °С и доводят объем при 20 °С до 1 л.

