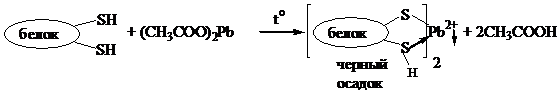В пробирку поместите 5-6 капель раствора яичного белка, добавьте равный объем 2 н раствора NaOH и по стенке добавьте 1-2 капли раствора сульфата меди (II). Наблюдается появление красно-фиолетовой окраски.
Возможная схема реакции:

Вопросы:
1. С какой целью может быть использована данная реакция в качественном анализе?
2. Могут ли дать положительную биуретовую реакцию a–аминокислоты?
Опыт 2. Ксантопротеиновая реакция белков.
В пробирку поместите 5 капель раствора яичного белка и 2 капли концентрированной азотной кислоты. Содержимое пробирку осторожно нагрейте, все время встряхивая. Раствор и осадок окрашиваются в желтый цвет. Охладив пробирку, осторожно добавьте 1-3 капли 2н раствора гидроксида натрия до появления ярко-оранжевой окраски.
Схема реакции:

Вопросы:
Å
1.Объясните ориентацию NO2 в бензольное кольцо.
2. Укажите тип и механизм реакции нитрования.
3. С какой целью может быть использована данная реакция в качественном анализе?
Опыт 3. Реакция на присутствие серосодержащих a-аминокислот.
В пробирку поместите 5 капель раствора яичного белка и вдвое больший объем 2н раствора NaOH. Содержимое пробирки перемешайте, нагрейте до кипения (1-2 мин). К полученному щелочному раствору добавьте 5 капель 10% ацетата свинца (П) и вновь прокипятите. Отметьте появление серо-черного осадка.
Схема реакции:
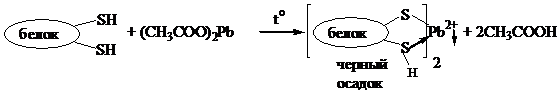
Вопросы:
1. По какому реакционному центру цистеина протекает данная реакция?
2. С какой целью может быть использована данная реакция в качественном анализе?
Опыт 4. Осаждение белков трихлоруксусной и сульфосалициловой кислотами.
К 5 каплям раствора белка добавьте 2 капли раствора сульфосалициловой кислоты. Повторите этот опыт с раствором трихлоруксусной кислоты. Выпадает осадок белка.
Вопросы:
1. Является ли обратимым процесс осаждения белков органическими кислотами?
2. Какие изменения протекают с белками в процессе денатурации?
Опыт 5. Осаждение белков дегидратирующими агентами.
В две пробирки поместите по 5 капель раствора яичного белка. В первую пробирку добавьте 10-15 капель этилового спирта, во вторую-столько же ацетона. Выпадает осадок белка.
Вопросы:
1. Является ли процесс денатурации под действием ацетона и спирта обратимым?
2. Какие изменения в степени гидратации белка наблюдаются под влиянием ацетона и спирта?
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Дипептид карнозин, найденный в мышцах человека, представляет собой b-аланил-гистидин. Напишите его структуру, определите рН в растворе пептида, его изоэлектрическую точку и суммарный заряд при рН 7,3-7,5.
2. В регуляции кровяного давления важнейшую роль играет ангиотензин II-линейный октапептид, который образуется из декапептида ангиотензина I путем отщепления дипептидного фрагмента Гис-Лей. Напишите структуру этого дипептида. Определите рН в его растворе и его изоэлектрическую точку и суммарный заряд в крови (рН 7,3-7,5).
3. Смесь пяти пептидов Р1, Р2, Р3, Р4;. Р5 подвергалась электрофорезу при рН 8,5. После окончания разделения и окраски получена электрофореграмма, показанная на рисунке. Все пептиды имели одинаковую молярную массу. Зная рI каждого пептида (9,0 для Р1; 5,5 для Р2; 10,2 для Р3; 8,2 для Р4, 7,2 для Р5). Определите, какая зона соответствует каждому пептиду.

4. После 10-летнего тщательного испытания в США разрешено использовать аспартам в качестве низкокалорийной добавки для придания продуктам сладкого вкуса (в 200 раз слаще сахара). По химической природе аспартам представляет собой метиловый эфир дипептида L-аспартил-L-фенилаланина. Напишите его структуру и схему образования метилового эфира из соответствующего дипептида. Укажите механизм реакции.
5. Глутатион защищает SH-группы белков в организме от окисления. Трипептид глутатион (g-глутамилцистеинилглицин) отличается по строению от других пептидов тем, что глутаминовая кислота в его составе представляет для образования пептидной связи не a-карбоксильную, а g-карбоксильную группу. Напишите его структуру, предположите за счет какой функциональной группы он может проявлять окислительно-восстановительные свойства, напишите схему окислительно-восстановительной реакции.
6. Тетрапептид тафцин является регулятором иммунной системы, обладает противоопухолевым и антибактериальным действием. Он имеет следующее строение: Тир-Лиз-Про-Арг. Определите область рН в изоэлектрической точке данного тетрапептида и его заряд в крови (рН 7,3-7,5).
7. Напишите продукты гидролиза пептида в присутствие ВrCN и трипсина:
Гли–Мет–Гли–Фен–Ала–Вал–Арг–Мет–Лей–Тир–Лиз–Гли–Ала.
Поясните роль частичного гидролиза в определении первичной структуры пептидов и белков.
8. В автоматическом приборе секвенаторе для определения аминокислотной последовательности пептидов используется метод Эдмана. Полученное на каждой стадии расщепления фенилтиогидантоиновое (ФТГ) производное идентифицируется методом хроматографии. Напишите схемы реакций, протекающих при расщеплении трипептида Лиз-Асп-Вал по методу Эдмана. Чем различаются ФТГ-производные аминокислот?
9. Пентапептид при полном гидролизе образует аргинин, аспарагиновую кислоту, лейцин, серин и тирозин. Для определения аминокислотной последовательности провели три последовательных расщепления по Эдману. После первого расщепления в составе пептида остались Арг, Асп, Лей, Сер, после второго-Арг, Асп, Сер, после третьего-Арг и Сер. Какова последовательность пентапептида? Напишите его структуру и приведите схему определения N-концевой аминокислоты по Эдману.
10. В 1995 году открыта группа пептидов, которые оказывают влияние на передачу нервных импульсов (энкефалины, опиатные пептиды). Первыми в этой группе открыты два пентапептида, оказывающих сильный обезболивающий эффект. Напишите структуру этих пептидов по указанной последовательности аминокислот. Определите рН среды в их растворе и изоэлектрическую точку пептидов.
а) Тир-Гли-Гли-Фен-Мет
б) Тир-Гли-Гли-Фен-Лей.
11. Гормон гипофиза вазопрессин имеет следующую последовательность аминокислот: Цис-Тир-Фен-Глн-Асн-Цис-Про-Арг-Глу. Прогнозируйте связи, которые могут фиксировать вторичную и третичную структуры данного пептида. Изобразите их схематично.
12. В фиброине шелка полипептидные цепи имеют вторичную структуру в виде антипараллельной b-структуры. Изобразите схематично ее строение, укажите типы связи, фиксирующие b-структуру.
13. a-спиральная вторичная структура полипептидной цепи полностью характерна для a-кератина шерсти; в белках миоглобине и гемоглобине содержание a-спирали составляет 75% вторичной структуры, в сывороточном альбумине 50%. Изобразите схематично строение a-спирали, укажите типы связей, фиксирующие ее.
14. Опишите, что вы знаете о природе различных типов связей и их роли в структуре белков:
а) пептидной связи;
б) дисульфидной связи;
в) водородной связи;
г) электростатических взаимодействий;
д) гидрофобных взаимодействий.
15. Схематично изобразите взаимодействия, фиксирующие третичную структуру белковой молекулы на участке полипептидной цепи:
а) – Цис-Асп-Вал-Цис-Лиз-Вал-
б) – Тир-Арг-Лей-Асп-Глу-Лей-
ЗАНЯТИЕ 16
НУКЛЕИНОВЫЕ КИСЛОТЫ.