В сухую пробирку поместите 3 капли абсолютного этанола и внесите кусочек металлического натрия, размером с рисовое зернышко. Соберите выделяющийся водород, прикрыв пробирку пробкой. Затем уберите пробку и поднесите пробирку отверстием к пламени горелки. Смесь водорода с воздухом сгорает с характерным «лающим» звуком. Белый осадок этилата натрия растворите в 2-4 каплях этанола и добавьте 1 каплю 1% раствора фенолфталеина. После этого внесите в пробирку 1-2 капли воды. Объясните появление малиновой окраски.
Схемы реакций:
 С2Н5ОН + Na C2H5O–Na+ + ½ H2
С2Н5ОН + Na C2H5O–Na+ + ½ H2
 C2H5O–Na+ + H2O С2Н5ОН + NaOH
C2H5O–Na+ + H2O С2Н5ОН + NaOH
Вопросы:
1. Какие свойства спиртов проявляются в реакции с металлическим натрием?
2. Почему в реакции используется абсолютный этанол?
3. Почему в воде этоксид натрия легко разлагается?
Опыт 2. Реакция глицерина с гидроксидом меди (II) в щелочной среде.
Поместите в пробирку 3 капли 0,2н CuSO4, 3 капли 2н NaOH и взболтайте. Появляется студенистый голубой осадок гидроксида меди (II). При нагревании в щелочной среде до кипения, полученный гидроксид меди (II) разлагается с выделением CuO черного цвета. Повторите опыт, но перед кипячением гидроксида меди II, добавьте в пробирку 1 каплю глицерина, перемешайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Щелочной раствор глицерата меди под названием реактива Гайнеса применяется в клинических лабораториях для обнаружения глюкозы в моче.
Схемы реакций:

Вопросы:
1. Какие свойства глицерин проявляет в реакции с гидроксидом меди (II)?
2. Сравните силу кислотных центров глицерина и этанола.
3. Для каких целей может быть использована данная реакция в качественном анализе?
Опыт №3. Образование фенолята натрия и разложение его кислотой.
В пробирку с 3 каплями воды поместите 2 капли жидкого фенола и встряхните. К возникшей мутной эмульсии добавляйте по каплям 2н NaОН до образования прозрачного раствора. Подкислите этот раствор несколькими каплями 2н раствора хлороводородной кислоты.
Схемы реакций:

Вопросы:
1. Сравните силу кислотных центров этанола и фенола.
2. Сравните способность к гидролизу фенолята натрия и этоксида натрия.
Опыт 4. Основность аминов.
Нанесите 1 каплю раствора диэтиламина на красную лакмусовую бумагу. Что вы наблюдаете? Приготовьте в пробирке эмульсию из 1 капли анилина и 3 капель воды. Нанесите 1 каплю полученной эмульсии на полоску универсальной индикаторной бумаги. Изменения окраски не наблюдается. Докажите основность анилина реакцией образования солей с сильными кислотами. Разделите оставшуюся эмульсию анилина на 2 пробирки. В одну пробирку добавьте 1 каплю 2н HСl. Эмульсия исчезает (образуется хорошо растворимая солянокислая соль анилина). В другую пробирку добавьте 1 каплю 2н H2SO4. При встряхивании выпадает кристаллический осадок труднорастворимой соли анилина.
Схемы реакций:

Вопросы:
1. Качественно оцените силу основных центров метиламина и анилина.
2. Почему эмульсия анилина в воде не изменяет окраску индикатора?
Задачи для самостоятельного решения
1. Соотнесите значение Ка – 6,3 . 10–2; 1,75 . 10–5; 1,35 . 10–5 со структурой следующих кислот: уксусной, пропионовой, дихлоруксусной. Обоснуйте взаимосвязь кислотности со строением этих кислот.
2. Обьясните причины различий рКа n -нитрофенола, фенола, n -крезола. Напишите схему реакции солеобразования с более сильной кислотой.

3. Соотнесите значения рКв – 3,4; 3,3; 9,4 со структурой следующих оснований: метиламин, диметиламин, анилин. Обоснуйте взаимосвязь основности со строением этих оснований.
4. Обьясните причины различий рКВН+ у гуанидина и мочевины. Напишите схему реакции солеобразования с более сильным основанием.

рКВНÅ 0,1 рКВНÅ 13,5
5. Используя факторы качественной оценки силы кислот и оснований, расположите в ряд по уменьшению кислотности следующие ОН-кислоты Бренстеда:
а) этанол, 2-хлорэтан, 2,2-дихлорэтанол;
б) фенол, n-нитрофенол, n-аминофенол;
в) этановая, этандиовая, пропандиовая кислоты;
г) этанол, фенол, этановая кислота.
6. Используя факторы качественной оценки силы кислот и оснований, расположите в ряд по уменьшению основности следующие основания Бренстеда:
а) этанол, этантиол, этанамин;
б) диэтиловый эфир, диэтиламин, диэтилсульфид;
в) n-аминофенол, анилин, n-аминобензойная кислота.
7. Качественно оцените силу кислотных центров в молекулах n-аминосалициловой кислоты (противотуберкулезное средство) и парацетамола (жаропонижающее и анальгезирующее средство). Напишите схему реакции солеобразования с более сильной кислотой.

8. Качественно оцените силу основных центров в молекулах гистамина и адреналина. Напишите схему реакции солеобразования с более сильным основанием.

9. Как средство, повышающее артериальное давление, норадреналин применяется в виде соли винной кислоты (2,3-дигидроксибутандиовая кислота). Определите место протонирования в молекуле норадреналина и напишите схему образования гидротартрата норадреналина.

10. 2,3-димеркаптопропанол применяют при отравлениях солями мышьяка, ртути и др. Качественно оцените силу кислотных центров и прогнозируйте продукт его взаимодействия с солями ртути (II).
11. Для повышения растворимости в воде b-(диэтиламино) этиловый эфир n-аминобензойной кислоты при действии хлороводородной кислоты превращают в моногидрохлорид, который известен в медицинской практике как новокаина гидрохлорид. Определите наиболее сильный основный центр в молекуле новокаина и напишите уравнение реакции солеобразования.

12. Алкалоид эфедрин экстрагируют из эфедры, разбавленной хлороводородной кислотой. Качественно оцените силу основных центров эфедрина и напишите схему реакции солеобразования.

13. a-Аминокислоты в водных растворах подвергаются ионизации. Качественно оцените силу основных и кислотных центров в молекуле природной a-аминокислоты гистидина и прогнозируйте их ионизацию в водных растворах:

14. Существует предположение, что дипептид карнозин, содержащийся в мышцах животных и человека, выполняет буферные функции при физиологических значениях рН за счет наличия имидазольного гетероцикла. Найдите кислотные и основные центры в составе имидазольного цикла и напишите схему ионизации их по кислотному и основному типам.

15. Разделите приведенные соединения на группы кислот и оснований Льюиса:

СВОДНЫЕ ВОПРОСЫ К ИТОГОВОМУ ЗАНЯТИЮ (МОДУЛЬ №1)
Вопросы№1:а).Классифицируйте соединение по функциональным группам
 ;
;  ;
;  ;
; 
б) Назовите по заместительной номенклатуре:
 ;
;  ;
;  ;
; 
Вопросы №2:
а). Приведите электронное строение сопряженной системы в органическом соединении. Укажите пиррольное и пиридиновое состояние гетероатомов:
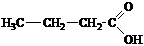 ;
;  ;
; 

б) Докажите ароматичность соединений:
 ;
;  ;
;  ;
; 
Вопросы №3:
Укажите вид и знак электронных эффектов заместителей в соединении. Определите электронодонорные и электроноакцепторные заместители:
 ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  ;
; 
Вопросы №4:
а). Напишите в проекциях Ньюмена возможные конформеры для бутандиовой кислоты (по связи С2-С3), для бутановой кислоты (по связи С2-С3).Приведите кривую изменения потенциальной энергии различных конформаций.
б). Приведите возможные конформации кресла для транс-циклогександиола-1,2, транс-циклогександиола-1,4, дайте их энергетическую характеристику.
Приведите возможные конформации кресла для миоинозита.Какая из них более энергетически выгодна? 
в). Напишите соответствующие конфигурационные стереоизомеры для указанных соединений. Укажите энантиомеры, σ- и/или π-диастереомеры.
 ;
;  ;
;  ;
;  ;
;
 ;
;  ;
;  ;
;  ;
;
 ;
; 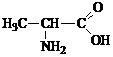 ;
;  ;
;  .
.
Вопросы №5:
а). Качественно оцените силу кислотных центров в молекулах:
 ;
;  ;
;  ;
;  ;
; 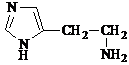
б). Качественно оцените силу основных центров в молекуле:
 ;
;  ;
; 
ЗАНЯТИЕ 5.
ОБЩИЕ ЗАКОНОМЕРНОСТИ РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИОННАЯ СПОСОБНОСТЬ УГЛЕВОДОРОДОВ. РЕАКЦИИ SR, AE, SE.
ЦЕЛЬ: Сформировать знания:
– понятий «химическая реакция», «субстрат», «реагент», «реакционный центр», «механизм реакции»;
– гомо– и гетеролитического расщепления ковалентных связей, классификации химических реакций по механизму;
– реакционной способности алканов в связи с электронным строением химических связей, механизма реакции радикального замещения (SR);
– реакционной способности алкенов и алкадиенов как следствия гетеролитического расщепления p-связи, механизма реакций электрофильного присоединения (АЕ);
– реакционной способности ароматических углеводородов, механизма реакций электрофильного замещения (SЕ);
– биологических аналогов указанных реакций.
Сформировать умения:
– прогнозировать возможность гомо- и гетеролитического расщепления связи;
– изображать механизмы указанных реакций;
– выполнять характерные и качественные реакции на углеводороды.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ
1. Химическая реакция как процесс. Понятия – субстрат, реагент, реакционный центр, продукт реакции. Классификация органических реакций. Понятие о механизме реакций, гомо- и гетеролитическое расщепление связей. Реакционная способность органических соединений. Электронное строение промежуточных частиц (свободные радикалы, карбокатионы, карбоанионы).
2. Реакционная способность алканов и циклоалканов. Механизм реакций радикального замещения (SR). Галогенирование алканов и циклоалканов (обычные циклы). Понятие о региоселективности, цепном процессе.
3. Реакционная способность алкенов и алкадиенов. Механизм реакций электрофильного присоединения (АE), гидрогалогенирование, гидратация. Правило Марковникова.
4. Реакционная способность ароматических соединений. Реакции электрофильного замещения (SE). Галогенирование, сульфирование, нитрование, алкилирование и ацилирование ароматических углеводородов и гетероциклических соединений.
5. Правило ориентации в бензольном ядре. Ориентанты первого и второго рода.
ЛИТЕРАТУРА
[1]. Тюкавкина Н.А., Биоорганическая химия. / Н.А.Тюкавкина, Ю.И. Бауков– М.: Медицина, 1991.– С. 117-148.
[2]. Гидранович Л.Г. Биоорганическая химия: Учеб. пособие. /Л.Г.Гидранович. – Витебск: ВГМУ, 2009.– С. 67-91.
[3]. Гидранович Л.Г. Лабораторные занятия по биоорганической химии.: Учеб. пособие / Л.Г.Гидранович. – Витебск: ВГМУ, 2012.– С. 36-42.
[4]. Гидранович Л.Г. Курс лекций по биоорганической химии.– Витебск.– 2003.– С. 59-78.
ЗАДАНИЯ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ.
1. Подготовить теоретический материал по вопросам для самоподготовки к занятиям.
2. Оформить протокол лабораторной работы.
3. Решить задачи 3-5, 8,11,13, представленные на страницах 40-42 данного лабораторного практикума.
Примерный вариант заключительного контроля:
1. Сравните реакционную способность в реакциях SR бутана и 2-метилбутана. Напишите схему реакции бромирования более активного из них. Опишите механизм реакции по стадиям.
2. Напишите схемы реакций, обозначьте графически реакционные центры, укажите тип и механизм реакций:

Содержание лабораторного практикума:



 С2Н5ОН + Na C2H5O–Na+ + ½ H2
С2Н5ОН + Na C2H5O–Na+ + ½ H2 C2H5O–Na+ + H2O С2Н5ОН + NaOH
C2H5O–Na+ + H2O С2Н5ОН + NaOH












 ;
;  ;
;  ;
; 
 ;
;  ;
;  ;
; 
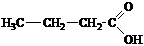 ;
;  ;
; 

 ;
;  ;
;  ;
; 
 ;
;  ;
;  ;
;  ;
;  ;
;  ;
; 

 ;
;  ;
;  ;
;  ;
; ;
;  ;
;  ;
;  ;
; ;
; 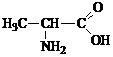 ;
;  ;
;  .
. ;
;  ;
;  ;
;  ;
; 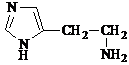
 ;
;  ;
; 



