

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Клинические аспекты
Лабораторной диагностики ВИЧ-инфекции
Минск 2007
УДК 616.98:578.828.6-074
ББК 55.148
Г 61
| Рецензент: | Еремин В.Ф.,д.м.н., руководитель отдела клинической вирусологии, руководитель лаборатории диагностики ВИЧ и сопутствующих инфекций ГУ НИИ эпидемиологии и микробиологии МЗ РБ |
Голобородько Н.В., Ключарева А.А.
Клинические аспекты лабораторной диагностики ВИЧ-инфекции. Пособие для практических врачей. – Мн.: БелМАПО, 2007. – хх с.
В пособии рассмотрены клинические аспекты лабораторной диагностики ВИЧ-инфекции, касающиеся постановки диагноза, слежения за ее течением, назначения и мониторинга эффективности антиретровирусной терапии.
Пособие предназначено для инфекционистов и врачей других специальностей, которые занимаются ведением пациентов с ВИЧ-инфекцией.
Пособие предназначено исключительно для образовательных целей и не заменяет рекомендаций национальных протоколов по ведению пациентов с ВИЧ-инфекцией.
Пособие составлено на основе лекций по ВИЧ-инфекции, которые читаются на курсах повышения квалификации «Лечение и профилактика ВИЧ-инфекции» и «ВИЧ-инфекция и парентеральные гепатиты» на кафедре детских инфекционных болезней БелМАПО, а также на основе данных литературных источников, указанных в списке литературы, приведенном в конце пособия. Материалы пособия в виде презентации лекции в формате PowerPoint можно заказать по электронной почте [email protected].
Пособие подготовлено при технической поддержке странового офиса ВОЗ в Республике Беларусь и выпущено в свет при финансовой поддержке …
УДК 616.98:578.828.6-074
ББК 55.148
|
|
© БелМАПО, 2007
© страновой офис ВОЗ в Республике Беларусь, 2007
Содержание
Список сокращений
1 Введение
1.1 Задачи лабораторной диагностики при ВИЧ-инфекции
1.2 Строение ВИЧ: что же мы определяем лабораторно?
1.3 Естественное течение ВИЧ-инфекции: клинико-лабораторные параллели
1.4 Лекарственная резистентность ВИЧ
1.5 Тесты для лабораторной диагностики при ВИЧ-инфекции
2 Лабораторные тесты
2.1 Иммуноферментный анализ
2.2 Иммуноблотинг
2.3 Быстрые тесты
2.4 Полимеразная цепная реакция
2.5 Определение количества CD4 лимфоцитов
2.6 Определение лекарственной резистентности
2.7 Забор, хранение и транспортировка материала
3 Клиническое использование результатов тестов
3.1 Определение ВИЧ-статуса
3.2 Снижение порога доступа к тестированию на ВИЧ
3.3 Определение лабораторных маркеров у пациентов, не получающих АРТ
3.4 Лабораторные данные в определении показаний к АРТ
3.5 Лабораторные данные в контроле эффективности АРТ
3.6 Определение лекарственной резистентности в выборе схемы АРТ
3.7 Лабораторные данные в выборе тактики ведения ВИЧ-позитивных беременных
Заключение
Приложение Классификация АРВ препаратов
Литература
Список сокращений
Ab антитела (от англ. antibody)
Ag антиген (от англ. antigen)
CD4 лимфоциты CD4-позитивные Т-лимфоциты хелперы
CDC Centers for Diseases Control and Prevention (Центры контроля и профилактики заболеваний США)
CI доверительный интервал
DHHS Department of Health and Human Services (Министерство здравоохранения и социальных служб США)
EuroGuidelines Group EuroGuidelines Group for HIV Resistance (Европейская группа по разработке клинических рекомендаций по резистентности ВИЧ)
IAS-USA International AIDS Society-USA (Международное общество борьбы со СПИДом)
IDSA Infectious Diseases Society of America (Американское общество инфекционистов)
lg десятичный логарифм (1 lg=10, 2 lg=100 и т.д.)
tо температура
VL, ВН вирусная нагрузка (от англ. viral load)
АРВ антиретровирусный
АРТ антиретровирусная терапия
ВИЧ вирус иммунодефицита человека
|
|
ВОЗ Всемирная организация здравоохранения
ДНК дезоксирибонуклеиновая кислота
ИБ иммунный блотинг
ИФА иммуноферментный анализ
ПМР передачи ВИЧ от матери ребенку
ПЦР полимеразная цепная реакция
РНК рибонуклеиновая кислота
СПИД синдром приобретенного иммунодефицита
Введение
Врачам-клиницистам при тестировании пациентов на ВИЧ-инфекцию и при ведении ВИЧ-инфицированных пациентов постоянно приходится сталкиваться с вопросами назначения и интерпретации лабораторных тестов. Это может вызвать затруднения у врачей, имеющих небольшой опыт работы в данной проблеме.
В настоящем пособии рассмотрены клинические аспекты лабораторной диагностики ВИЧ-инфекции, касающиеся постановки диагноза, слежения за ее течением, назначения и мониторинга эффективности антиретровирусной терапии (АРТ). Вопросы лабораторной диагностики оппортунистических инфекций оставлены за рамками настоящего пособия.
Лабораторные тесты
Иммуноферментный анализ
Иммуноферментный анализ (ИФА, англ. – EIA или ELISA) подразумевает определение суммарных антител и/или антигенов ВИЧ в биологических жидкостях.
Биологические жидкости, в которых можно определять антитела к ВИЧ:
§ сыворотка крови, полученная путем центрифугирования цельной крови, – наиболее распространено определение антител именно в сыворотке крови;
§ цельная капиллярная кровь, взятая из пальца;
§ транссудат слизистой полости рта, собранный с помощью специальной пластинки (тесты OraSure, Oral Fluid, OMT-EIA);
§ моча (быстрый тест Calypte HIV-1 Test для постановки врачом);
§ вагинальные выделения (быстрый тест Wellcozyme для определения IgG у жертв изнасилования).
Принцип метода ИФА-диагностики представлен на рис. 3.
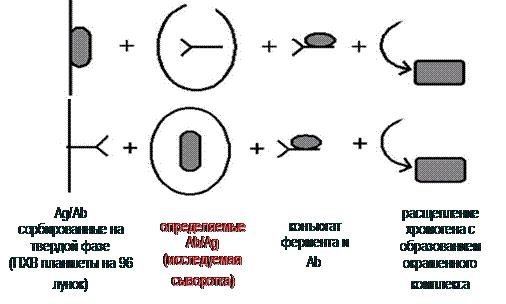
Рис. 3. Принцип постановки иммуноферментного анализа (ИФА)
Существуют несколько поколений тестов для ИФА (табл. 1). Тесты всех поколений выявляют общие (суммарные) антитела к ВИЧ, а тесты 4 поколения – еще и р24 антиген ВИЧ («комбинированный тест»).
Таблица 1 – Характеристика тестов для ИФА различных поколений
| поколение тестов | определение Ab | определение Ag |
| первое | основаны на нативном вирусе | нет |
| второе | основаны на рекомбинантных белках или синтетических пептидах | нет |
| третье | в качестве конъюгата меченные белки ВИЧ | нет |
| четвертое | в качестве конъюгата меченные белки ВИЧ | определяют р24 антиген |
|
|
В Беларуси в последнее время применяются ИФА тесты 3 и 4 поколений. Они обладают высокой чувствительностью – приближающейся к 100% (то есть вероятность получения ложноотрицательного результата практически исключается) и чуть более низкой специфичностью – около 98-99% (то есть у небольшой части обследованных, до 2%, результат будет ложноположительным). Поэтому ИФА считается не диагностическим, а скрининговым тестом, и при получении положительного результата ИФА-теста следует провести подтверждающий тест (иммуноблотинг).
ИФА тесты 4 поколения позволяют выявить кровь ВИЧ-позитивного человека уже вскоре после появления виремии, включая большую часть периода «серологического окна», когда антитела еще не наработаны, но в крови уже имеется р24 антиген (рис. 4). Поэтому в Беларуси ИФА тесты 4 поколения используются при тестировании донорской крови.

Рис. 4. Возможности различных тестов в раннем выявлении ВИЧ-инфекции [цит. по Р.Торстенссону, Шведский институт по контролю за инфекционными заболеваниями, 2005]
Определение р24 антигена ранее (до появления ДНК ПЦР) применяли также для диагностики ВИЧ-инфекции у детей, рожденных ВИЧ-позитивными матерями, поскольку у таких детей в первые месяцы жизни (до 18 месяцев) могут циркулировать как собственные, так и материнские антитела, следовательно, определение антител не имеет большой информативности. Также определение р24 антигена использовали в качестве экономичного способа определения вирусной нагрузки в условиях ограниченных ресурсов.
Иммуноблотинг
Иммуноблотинг (ИБ, англ. – western blot, WB) подразумевает определение антител к отдельным белкам ВИЧ в биологических жидкостях.
По своей сути метод ИБ схож с ИФА. Отличие состоит в том, что сыворотку пациента добавляют не в лунку с адсорбированным «общим» антигеном ВИЧ, а вносят на панель с отдельными вирусными белками, которые предварительно были электрофоретически «разогнаны» на отдельные фракции сообразно их молекулярной массе. То есть в результате постановки ИБ мы получаем заключение о наличии в образце не общих антител к ВИЧ, а антител к отдельным белкам ВИЧ-1, в том числе к белкам сердцевины вируса (p17, p24, p55), гликопротеинам оболочки (gp41, gp120, gp160) и ферментам (p31, p51, p66).
|
|
Принцип метода ИБ представлен на рис. 5.

| 1. Электрофоретическое разделение белков ВИЧ-1 (стандартный реагент) по их молекулярной массе 2. Инкубация с добавлением исследуемой сыворотки – специфическое соединение белков ВИЧ с соответствующими отдельными антителами к ВИЧ из добавленной сыворотки 3. Инкубация с добавлением меченных ферментом антител к человеческим Ig 4. Детекция окрашенных полос |
Рис. 5. Принцип постановки иммуноблотинга (ИБ) [цит. по Э. Фаучи, К. Лэйн, 2003]
Критериями положительного результата ИБ являются:
§ по ВОЗ: сочетание 2 полос, соответствующих gp41 и gp120/gp160;
§ по CDC/APHL: сочетание 2 полос, соответствующих любым 2 из 3 антигенов ВИЧ – p24, gp41, gp120/gp160.
Критерием отрицательного ИБ является отсутствие полос.
Критерием неопределенного ИБ является наличие любых полос, сочетание которых не удовлетворяет критериям положительного результата.
Трактовку результатов ИБ осуществляет врач-лаборант, который выдает клиницисту заключение «ИБ положительный» или «ИБ отрицательный». Примеры интерпретации результатов ИБ приведены на рис. 6.

| 1. Положительный ИБ к ВИЧ-1 2. Отрицательный ИБ (у здорового человека, иммунизированного белками внешней оболочки ВИЧ-1) 3. Сомнительный ИБ (у инфицированного ВИЧ-2) 4. Сомнительный ИБ (наличие антител, перекрестно реагирующих с p24 Ag) 5. Отрицательный ИБ |
Рис. 6. Трактовка результатов иммуноблотинга (ИБ) [цит. по Э. Фаучи, К. Лэйн, 2003]
Тесты для ИБ более дороги, чем для ИФА, но обладают значительно более высокой специфичностью. Поэтому ИБ не применяется для скрининга, а является подтверждающим тестом при получении положительного результата в ИФА. При проведении обследования пациента, от момента заражения которого прошло >3 месяцев, по стандартной методике с двукратным тестированием в ИФА и подтверждением в ИБ чувствительность составляет 99,5% (95%CI 98-99,9%), а специфичность – 99,994%.
Ложноотрицательные результаты определения антител к ВИЧ в ИФА/ИБ у некоторых пациентов (около 0,3% в популяциях с высокой распространенностью ВИЧ-инфекции и <0,001% в популяциях с низкой распространенностью) обусловлены возможностью затягивания периода «серологического окна» до 6 месяцев, появления серореверсии на поздних стадиях ВИЧ-инфекции или у длительно получающих АРТ пациентов, идиопатической «атипичной иммунной реакцией», агаммаглобулинемией, инфицированием штаммом ВИЧ-2 или ВИЧ-1 О- или N- групп, а также возможностью технической или канцелярской ошибки.
|
|
Ложноположительные результаты определения антител к ВИЧ в ИФА/ИБ являются казуистикой (частота встречаемости 0,0004-0,0007%) и могут быть обусловлены появлением аутоантител, обнаружением поствакцинальных антител (у пациентов, участвующих в клинических испытаниях вакцин против ВИЧ), а также возможностью технической или канцелярской ошибки. Ложноположительный результат можно заподозрить, если у пациента отсутствуют факторы риска инфицирования ВИЧ, не определяется вирусная нагрузка и показатели количества CD4 лимфоцитов в пределах нормы. В этом случае серологическое обследование следует провести повторно.
Кроме всего прочего, пациенты могут сообщать врачу ложные сведения о якобы отрицательных результатах теста на ВИЧ (что наблюдается достаточно часто при фиксировании пациента на «стадии отрицания» нормальной реакции принятия диагноза) или о якобы положительных результатах теста (пациенты с синдромом Мюнхгаузена).
Неопределенные результаты ИБ получают достаточно часто – в 4-20% случаев. Неопределенный результат ИБ может быть обусловлен обследованием во время сероконверсии (обычно первыми появляются антитела к р24, затем – другие) или на поздних стадиях ВИЧ-инфекции (когда обычно исчезают антитела к белкам сердцевины), при наличии перекрестно реагирующих неспецифических антител (при коллагенозах, васкулитах, других аутоиммунных заболеваниях, лимфомах, заболеваниях печени, инъекционном потреблении наркотиков, рассеянном склерозе, во время беременности и после недавней иммунизации), при инфицировании штаммом ВИЧ-2 или ВИЧ-1 О- или N- групп, при обнаружении поствакцинальных антител (у пациентов, участвующих в клинических испытаниях вакцин против ВИЧ), а также возможностью технической или канцелярской ошибки.
При получении неопределенного результата ИБ рекомендуется оценить риск инфицирования ВИЧ у данного пациента, провести повторное серологическое тестирование (у не имеющих риска инфицирования пациентов – через 3 месяца, у имеющих риск инфицирования пациентов – через 1, 2 и 6 месяцев) и предложить пациенту принимать меры по профилактике передачи вируса вплоть до подтверждения его отсутствия. В спорных случаях возможно тестирование на наличие ДНК ВИЧ в качественной ПЦР (см. ниже).
Быстрые тесты
Быстрые тесты (или экспресс тесты) позволяют выявлять антитела к ВИЧ быстро (за 10-30 минут) и без использования специальной лабораторной техники.
Быстрые тесты выявляют антитела к ВИЧ, методики их постановки разнятся.
В табл. 2 приведена информация об экспресс-тестах на ВИЧ, на рис. 7 – пример использования наиболее распространенного теста OraQuick.
Таблица 2 – Экспресс-тесты на ВИЧ, одобренные FDA [цит. по Дж. Бартлетту, 2006]
| тест | производитель | образец | требования к лаборатории (CILA) | чувствительность, % | специфичность, % | что определяет | время постановки |
| OraQuick | OraSure Technologies | Кровь * Плазма Транссудат слизистой ротовой полости | Простые (не требуют сертификации) ** | 99,6 99,6 99,6 | 99,8 99,8 99,7 | ВИЧ-1 и 2 | 20 мин 20-40 мин |
| UniGold Recombigen | Trinity Biotech | Кровь * Плазма Сыворотка | Простые (не требуют сертификации) ** | 99,7 99,8 99,8 | ВИЧ-1 | 10 мин | |
| Reveal G2 | MedMira Inc. | Плазма Сыворотка | Средней сложности | 99,8 99,8 | 99,1 98,6 | ВИЧ-1 | 5 мин |
| Multispot HIV-1/HIV-2 HIV-2 | Bio-Rad Labs | Сыворотка Сыворотка | Средней сложности | 99,9 | Различает ВИЧ-1 и ВИЧ-2 | 15 мин |
* при исследовании образца крови не требуется проводить центрифугирование или использовать другое лабораторное оборудование
** не требуется наличия специального образования у медицинского персонала, контроля качества проведения тестов и профессионального уровня персонала, могут проводиться в лабораториях, клиниках, машинах медслужб, кабинетах врачей и т. п.

| Тестполоска OraQuick® методика использования: § специальным скарификатором взять из пальца каплю цельной капиллярной крови, § перенести во флакон c буфером и перемешать, § через 20 минут в окошке можно считывать результат. |
Рис. 7. Принцип постановки быстрого теста OraQuick [цит. по A.M. Khalsa, Pacific AIDS Education and Training Center KECK School of Medicine, 2003]
Чувствительность и специфичность быстрых тестов составляют 99-100%, то есть эти показатели сопоставимы с получаемыми в ИФА. Отрицательный результат тестирования свидетельствует об отсутствии антител к ВИЧ и не нуждается в подтверждении другими тестами. При положительном результате быстрого теста диагноз ВИЧ-инфекции должен быть обязательно подтвержден по стандартной методике (с использованием ИФА и ИБ). При получении неопределенного результата тестирование следует провести повторно через месяц.
Быстрые тесты применяют:
§ для экстренного уточнения ВИЧ-статуса в медучреждениях (обследование беременных, поступивших рожать с неизвестным ВИЧ-статусом, и обследование биоматериала при профессиональных контактах);
§ для обследования пациентов, которые с малой вероятностью придут за результатами тестирования, в том числе посетителей венерологических клиник и пациентов, которым оказывается неотложная помощь;
§ для домашнего использования (неоднозначное отношение в мире).
Методикой постановки быстрого теста должен владеть любой медработник, оказывающий экстренную помощь, работающий с беременными или вступающий в контакт с кровью пациента – например, акушер дежурной бригады или врач приемного покоя.
В комплект теста для домашнего использования входит информационный буклет для пациентов, где разъяснена техника постановки теста.
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР, англ. – PCR) подразумевает определение нуклеиновых кислот (РНК или ДНК) ВИЧ в биологических жидкостях.
Принцип метода ПЦР-диагностики представлен на рис. 8.
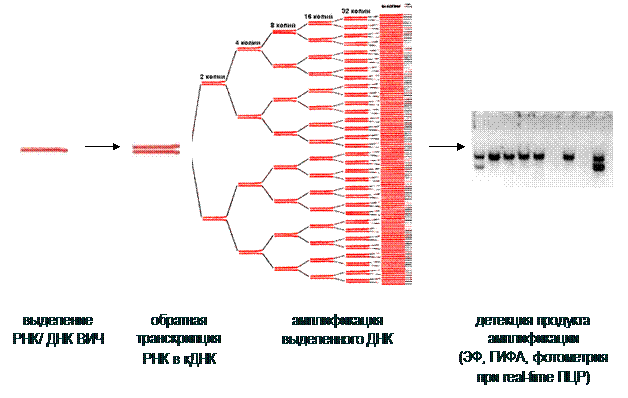
Рис. 8. Принцип постановки полимеразной цепной реакции (ПЦР)
При ВИЧ-инфекции используются два варианта ПЦР: качественная и количественная, или вирусная нагрузка (табл.3).
Таблица 3 – Характеристики качественной и количественной ПЦР, используемых для диагностики ВИЧ
| что определяет | материал для исследования | клиническое использование | |
| качественная | «ДНК-ПЦР»: наличие ДНК ВИЧ, интегрированного в геном клетки-мишени (лимфоцита) – резервуара инфекции | культура лимфоцитов крови | - определение ВИЧ-статуса в случаях, когда использование для этих целей ИФА/ИБ некорректно |
| количественная (вирусная нагрузка) | «РНК-ПЦР»: наличие РНК свободных вирионов ВИЧ, находящихся в плазме | плазма крови | - прогнозирование течения ВИЧ-инфекции у пациентов без терапии; - контроль эффективности АРТ (стартовая VL и в динамике); - выбор тактики ведения ВИЧ-позитивных беременных |
Качественная ПЦР проводится с целью определения ДНК ВИЧ в лимфоцитах крови для установления ВИЧ-статуса пациента.
Порог чувствительности выявления ДНК ВИЧ методом качественной ПЦР составляет около 5 копий на 106 клеток. Метод тем не менее считается несколько менее точным для диагностики ВИЧ-инфекции, чем ИФА/ИБ, и используется в следующих случаях:
1) когда использование ИФА/ИБ для установления ВИЧ-статуса некорректно:
§ у ВИЧ-экспонированных детей (если у ребенка первых 18 месяцев жизни выявляются антитела к ВИЧ, то неясно чьи они – собственные или материнские);
§ в период «серологического окна» (т.е. когда у инфицированного ВИЧ пациента антитела еще отсутствуют или субопределяемы – см. рис. 4): после профессиональных контактов, при наличии клиники острого ретровирусного синдрома, при тестировании донорской крови (исследование пулированных образцов);
2) для уточнения неопределенных результатов тестирования в ИФА/ИБ.
Для постановки качественной ПЦР с целью установления ВИЧ-статуса ребенка, рожденного ВИЧ-позитивной матерью, не используют пуповинную кровь, так как она может содержать материнскую кровь, а исследуют только кровь ребенка.
Положительный результат ПЦР-определения ДНК ВИЧ в первые 48 часов жизни ребенка позволяет предположить внутриутробное заражение. Вероятность обнаружения ДНК ВИЧ в первые 48 часов жизни ребенка составляет всего 17-38%. Если на первой неделе жизни ПЦР-определение ДНК ВИЧ дает отрицательный результат, а впоследствии – положительный, то считается, что заражение ребенка произошло во время родов. К возрасту 1 месяца ДНК ВИЧ обнаруживается практически у всех инфицированных детей: чувствительность составляет 98%, а специфичность – 99%.
Для постановки диагноза ВИЧ-инфекции ребенку, рожденному ВИЧ-позитивной матерью, обычно проводится двукратное ПЦР-исследование с интервалом 2-3 месяца. Получение отрицательного результата свидетельствует об отсутствии ВИЧ-инфекции, но требует подтверждения путем параллельного получения отрицательного результата в ИФА/ ИБ.
Вирусная нагрузка (ВН, англ. – VL), или количественная ПЦР, проводится с целью определения количества вирусов (РНК ВИЧ) в плазме крови пациента.
Определение вирусной нагрузки имеет значение для:
§ прогноза течения ВИЧ-инфекции (вирусная нагрузка позволяет предсказать скорость снижения количества CD4 лимфоцитов);
§ контроля эффективности проводимой АРТ в динамике (вирусологическая эффективность), вирусная нагрузка – самый важный тест для оценки эффективности терапии;
§ прогноза вероятности передачи ВИЧ (она выше при высокой вирусной нагрузке) как при профессиональных и половых контактах, так и при передаче ВИЧ от матери ребенку, и, соответственно, для выбора схемы медикаментозной постконтактной профилактики и выбора тактики ведения ВИЧ-позитивных беременных;
§ для постановки предварительного диагноза ВИЧ-инфекции пациенту, имеющему симптомы острой ВИЧ-инфекции (диагноз можно предполагать только при обнаружении высокой вирусной нагрузки – выше 100 тысяч копий/мл, и в последующем диагноз следует подтвердить стандартными методами – ИФА/ИБ).
Характеристика используемых для измерения уровня вирусной нагрузки тест-систем представлена в табл. 4.
Таблица 4 – Тест-системы для измерения уровня вирусной нагрузки, одобренные FDA [цит. по Дж. Бартлетту, 2006]
| Торговое название | Amplicor HIV Monitor 1.5 | Versant HIV-1 RNA3.0 | NucliSens HIV-1 QT |
| Производитель | Roche | Bayer | bioMerieux |
| Техника | ОТ-ПЦР | рДНК | NASBA |
| Сравнение результатов | Результаты, получаемые методом ОТ-ПЦР, сравнимы с результатами, получаемыми методом рДНК (Versant) с использованием тест-систем 2.0 и 3.0 | Результаты, получаемые методом рДНК, сравнимы с результатами, получаемыми методом ОТ-ПЦР (Amplicor) | Результаты, по-видимому, сравнимы с результатами, получаемыми методами ОТ-ПЦР и рДНК, но пока не получено достаточно данных |
| Преимущества / недостатки | • Меньше ложноположительных результатов у ВИЧ-отрицательных пациентов по сравнению с тест-системами фирмы Bayer. | • Занимает меньше времени. • Хороший динамический диапазон, но выше порог неопределяемой вирусной нагрузки. | • Может применяться для обнаружения вируса в тканях и биологических жидкостях, например, выделениях половых путей. • Самый большой динамический диапазон. |
| Динамический диапазон | • Стандартный: (Amplicor 1.5) 400-750 000 копий/мл • Суперчувствительный: (Ultra-Direct 1.5) 50-100 000 копий/мл | рДНК 3.0: 75-500 000 копий/мл* | Количественный тест на ВИЧ-1 NucliSens: 176-3 500 000 копий/мл; динамический диапазон зависит от объема |
| Подтип вируса | Тест-система 1.5: от А до G | от А до G | от А до G |
| Необходимый объем материала для исследования | • Amplicor: 0,2 мл • Суперчувствительный: 0,5 мл | 1 мл | От 10 мкл до 2 мл |
| Пробирки | ЭДТА (пробирка с сиреневой крышкой) | ЭДТА (пробирка с сиреневой крышкой) | ЭДТА, гепарин, цельная кровь, любая биологическая жидкость, МКПК, семенная жидкость, ткани и т. д. |
| Требования | Отделить плазму не позже чем через 6 часов после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. | Отделить плазму не позже чем через 4 часа после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. | Отделить сыворотку или плазму не позже чем через 4 часа после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. |
* нижний порог измерений, установленный FDA, равен 50 копий/мл
Используемые для определения вирусной нагрузки тесты обычно определяют наличие РНК ВИЧ-1 субтипов В или А-G (группа М). Тесты недостаточно точны для выявления ВИЧ-1 групп N или О, а также ВИЧ-2.
Вирусная нагрузка определяется обычно в плазме крови, но некоторыми тестами ее можно определять и в других биологических жидкостях, например, в семенной жидкости, вагинальных выделениях, спинномозговой жидкости, грудном молоке, слюне.
Диапазон определяемых значений вирусной нагрузки различен для разных тест-систем. Минимальный порог определения для используемых в настоящее время в Беларуси тестов составляет 1 500 копий/мл, то есть термин «неопределяемая вирусная нагрузка» не означает отсутствия вируса в крови, а говорит о том, что его количество составляет менее порога определения для данной тест-системы (в нашем случае < 1 500 копий/мл).
Чувствительность теста составляет около 100% при острой ВИЧ-инфекции; специфичность в среднем 97%, но при вирусной нагрузке >10 000 копий/мл приближается к 100%.
Специфичность теста составляет 91-98%, поэтому тест не используется для диагностики ВИЧ-инфекции. Ложноположительные результаты у неинфицированных пациентов регистрируются в 2-9%, обычно показывая низкую концентрацию вируса (<10 000 копий/мл). Диагноз ВИЧ-инфекции, выставленный при обнаружении РНК ВИЧ в крови, должен быть подтвержден стандартными тестами – постановкой качественной ПЦР (определение ДНК ВИЧ) или постановкой ИБ (с повтором ИБ спустя 2-4 месяца после начального сомнительного или отрицательного теста).
Приведенная в табл. 5 градация уровней вирусной нагрузки является в определенной степени условной, но позволяет выделять порог возможного старта прогрессирования ВИЧ-инфекции, при регистрации которого требуется дополнительная оценка клинического статуса и количества CD4 лимфоцитов для решения вопроса о начале АРТ. Вирусная нагрузка в пределах до 5 тысяч копий/мл говорит о низком риске прогрессирования ВИЧ, порог возможного старта прогрессирования составляет > 55 тысяч копий/мл для подростков и взрослых и > 100 тысяч копий/мл (или даже более высокие значения) для детей.
Таблица 5 – Условная градация уровней вирусной нагрузки
| градация уровней | VL, копий/мл (методом RT-PCR) |
| порог определения | < 50 * < 1 500 ** |
| очень низкий уровень | 1 500 - 7 тысяч |
| низкий уровень | 7 - 20 тысяч |
| умеренный уровень | 20 - 55 тысяч |
| порог возможного старта прогрессирования ВИЧ-инфекции | > 55 тысяч у подростков и взрослых > 100 тысяч у детей |
| высокая вирусная нагрузка | > 80 - 100 тысяч |
* порог определения, достигаемый при использовании некоторых тест-систем и принятый в клинических рекомендациях по оценке эффективности АРТ
** порог определения для используемых в настоящее время в Беларуси тест-систем
Вирусная нагрузка у мужчин на фоне сохранного иммунитета может быть несколько выше, чем у женщин (до 2 раз), но при снижении количества CD4 лимфоцитов (<300 клеток/мкл) эти различия исчезают. Поэтому при оценке уровня вирусной нагрузки при принятии лечения о начале АРТ пол пациента не учитывают.
Клиническая трактовка результатов определения вирусной нагрузки сложна, так как:
§ возможны естественные колебания VL в условиях полного благополучия;
§ транзиторное повышение уровня VL могут вызвать появление острого эпизода оппортунистической инфекции или вакцинация;
§ определяемый уровень вирусной нагрузки в крови может не отражать уровень вирусной нагрузки в других тканях (например, в эпителии и выделениях из половых путей, в лимфатических узлах, в ЦНС, в ЖКТ).
Поэтому при трактовке результатов определения вирусной нагрузки следует учитывать следующее:
§ забор крови на VL следует проводить не ранее чем через 2-4 недели после исчезновения симптомов острой инфекции (если невозможно – то все заборы проводить в примерно схожем клиническом состоянии пациента) или вакцинации;
§ исследование крови следует проводить всегда одним и тем же методом в одной и той же лаборатории;
§ значимыми колебаниями VL следует считать колебания более чем в 2-3 раза (поскольку 95%CI для результатов теста составляет 0,3-0,5 lg) – например, повышение с 20 тысяч до более чем 40-60 тысяч копий/мл; при сомнениях, выросла ли VL или осталась на прежнем уровне, следует повторить анализ;
§ результаты определения VL должны заново перепроверяться перед стартом или изменением АРТ.
Существуют особенности вирусной нагрузки у детей:
§ в целом дети имеют более высокие уровни VL, высокой считается VL > 100 тысяч копий/мл;
§ при перинатальной ВИЧ-инфекции: при рождении VL обычно не определяется или низкая (до 10 тысяч копий/мл), ко 2 месяцу жизни достигает высоких значений (более 100 тысяч копий/мл), а затем в течение нескольких лет медленно снижается (в течение первых 2 лет в среднем на 0,6 lg в год, в течение следующих 4-5 лет – на 0,3 lg в год).
На основании уровня вирусной нагрузки нельзя судить о степени повреждения функции иммунной системы и о чувствительности вируса к АРВ препаратам.
Определение ВИЧ-статуса
В настоящее время в Беларуси обеспечена широкая доступность тестирования на ВИЧ. В приложении №4 к приказу МЗ РБ от 16.12.1998 г. № 351 определено, что «Право на анонимное и добровольное обследование на наличие антител к вирусу иммунодефицита человека предоставлено любому гражданину, независимо от места жительства, в любом лечебно-профилактическом учреждении, имеющем процедурный кабинет».
Добровольность тестирования на ВИЧ подразумевает либо добровольное включение в тестирование (при наличии желания/ запроса самого пациента), либо добровольное исключение (предложение о тестировании исходит от врача, а пациент имеет возможность согласиться или отказаться).
Кроме того, в приложении 8 к приказу МЗ РБ от 16.12.1998 г. № 351 определен «Перечень контингентов, подлежащих обследованию на наличие антител к вирусу иммунодефицита человека», то есть подлежащих обязательному тестированию на ВИЧ. В кратком изложении данный перечень может быть представлен следующим образом:
§ доноры;
§ иностранные граждане;
§ лица из очагов: бывшие в половом контакте с ВИЧ-позитивным или в сходных условиях по риску заражения ВИЧ;
§ по клиническим показаниям (при наличии проявлений некоторых оппортунистических инфекций или ряда возможных признаков иммунодефицита) – обследуются как пациенты, так и аутопсийный материал;
§ получающие частые гемотрансфузии;
§ плацентарная кровь, поступающая на переработку;
§ дети ВИЧ-позитивных матерей или оформляющиеся в госучреждения;
§ пациенты с инфекциями, передающимися половым путем;
§ потребители инъекционных наркотиков, мужчины имеющие секс с мужчинами, женщины секс бизнеса;
§ поступившие в следственный изолятор или приемник-распределитель;
§ медработники в случае профессионального контакта;
§ а также все изъявившие пройти обследование, в том числе анонимно.
Руководство IDSA по оказанию первичной медицинской помощи приводит следующие показания к тестированию на ВИЧ:
§ взрослые из групп риска, частота выявления ВИЧ-инфицированных в которых составляет >1%;
§ беременные;
§ жертвы сексуального насилия;
§ контакт с ВИЧ на рабочем месте;
§ личное желание пройти тестирование на ВИЧ.
При постановке теста на ВИЧ проводится до- и послетестовое консультирование пациентов, согласно приказу МЗ РБ от 13.12.2001 №712-А «О проведении консультирования по вопросам ВИЧ-инфекции пациентов лечебно-профилактических учреждений».
Рекомендуемая частота обследования на ВИЧ-инфекцию зависит от конкретной ситуации. Так, пациентам из групп высокого риска обычно рекомендуют обследоваться ежегодно, поскольку они имеют высокие показатели частоты ежегодной сероконверсии (если для населения в целом этот показатель составляет 0,001%, для военнослужащих срочной службы – 0,04%, то для мужчин имеющих секс с мужчинами – 0,5–2% с более высоким риском у молодых, а для потребителей инъекционных наркотиков в регионах с высокой распространенностью ВИЧ-инфекции – 0,7–6%).
Рутинно используемый диагностический алгоритм обследования на ВИЧ-инфекцию включает определение антител в ИФА, выполненном двукратно, с последующим подтверждением в ИБ.
Обобщенная диагностическая схема представлена на рис. 9, детали наблюдения при различных результатах первичного тестирования в ИФА и ИБ описаны в приложении 12 к приказу МЗ РБ от 16.12.1998 г. № 351 «Организация диспансерного наблюдения за ВИЧ-инфицированными и подозрительными на заражение ВИЧ лицами».

Рис. 9. Диагностический алгоритм обследования на ВИЧ-инфекцию
Диагноз ВИЧ-инфекции подтверждается при получении положительных результатов двух ИФА и одного ИБ. Если получены отрицательные результаты ИФА или ИБ, но при консультировании установлено, что пациент имел риск заражения ВИЧ в недавнем прошлом (в последние 6 месяцев), то через некоторое время (обычно через 1-3-6 месяцев) проводится повторное обследование в ИФА/ ИБ или проводится качественная ПЦР. Если получены отрицательные результаты ИФА или ИБ, и при консультировании установлено, что пациент не имел риска заражения ВИЧ в недавнем прошлом, диагноз ВИЧ-инфекции исключается.
Диагностический алгоритм обследования на ВИЧ-инфекцию детей, рожденных ВИЧ-позитивными матерями, включает определение ДНК ВИЧ (качественная ПЦР) и антител к ВИЧ (ИФА и ИБ).
«Инструкция по медицинскому наблюдению за ВИЧ-экспонированными/ инфицированными детьми», утвержденная приказом МЗ РБ от 05.09.2003 г. № 147, регламентирует проведение качественной ПЦР в 2 и 4 месячном возрасте и определение антител к ВИЧ в ИФА/ ИБ в возрасте 6, 12 и 18 месяцев. Получение двух отрицательных результатов качественной ПЦР позволяет исключить диагноз ВИЧ-инфекции, но снятие ребенка с диспансерного учета по ВИЧ-экспоненции происходит после получения двух отрицательных результатов определения антител в ИФА/ ИБ (обычно в 18-месячном возрасте).
Рекомендации ВОЗ 2006 г. определяют проведение качественной ПЦР детям в возрасте 48 часов после рождения, затем в 1,5 и 3 месяца. Причем отрицательный результат первого ПЦР-теста, выполненного в возрасте 48 часов после рождения, клинически не трактуется, поскольку при интранатальном заражении вирус появляется в крови позже.
Заключение
Клиническая работа по разделу ВИЧ-инфекции на настоящее время немыслима без использования целого ряда определяемых лабораторно показателей, которые служат как для постановки диагноза ВИЧ-инфекции, так и для слежения за течением ВИЧ-инфекции и эффективностью проводимого антиретровирусного лечения. Умение интерпретации результатов лабораторных тестов – необходимое условие качественной работы клинического врача.
Ниже приводим ряд ключевых позиций, изложенных в данном пособии, которые должны быть усвоены курсантами:
œ Рутинно диагноз ВИЧ-инфекции устанавливают при серологическом обследовании, тестирование включает получение положительных результатов двух тестов ИФА и одного подтверждающего теста
|
|
|

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!