ОВР, основой которых является обмен электронами, протекают между двумя редокс-парами.
Условно ОВ реакции относятся к 3-му типу и в общем виде они записываются:

При рассмотрении вопроса о возможности их использования в титриметрии необходимо дать ответ на следующие вопросы:
1) протекают ли реакция между данным окислителем и восстановителем?
Ответ на этот вопрос дается путем сравнения табличных значений нормальных редокс-потенциалов окислителя и восстановителя;
2) имеется ли скачок на кривой титрования, т.е. DЕ0 > 0, где DЕ0 = Е0ок - Е0восс
Титрование по методу окисления – восстановления возможно если DЕ0 > 0,4 В.Только в этом случае обеспечивается необходимая полнота и скорость реакции.
Кроме того, о наличии скачка титрования конкретной ОВ реакции судят по значению ее константы равновесия.


 Существует связь между константой равновесия редокс-реакции К и разностью нормальных редокс-потенциалов DЕ0. Величину К вычисляют, исходя из ЭДС полной реакции
Существует связь между константой равновесия редокс-реакции К и разностью нормальных редокс-потенциалов DЕ0. Величину К вычисляют, исходя из ЭДС полной реакции 
где n -число электронов, переходящих в процессе стехиометрической реакции.
Титрантами в ОВ титровании служат растворы окислителя и восстановителя. Если раствор восстановителя титруется стандартным раствором окислителя то метод называют «оксидиметрия», если же раствор окислителя титруется стандартным раствором восстановителя то метод называют «редуктометрия» В зависимости от условий окислитель и восстановитель могут вступать в реакции, в которых участвует разное количество электронов. Поэтому часто титранты не имеют постоянного эквивалента. Например, в кислой среде ион MnO4¯ присоединяет 5 электронов, в щелочной - 1, в нейтральной - 3. Поэтому в кислой среде молярная масса эквивалента М( KMnO4) = 158,04/5 = 31,6 г/моль, в щелочной среде М(KMnO4) = 158,04; в нейтральной - М(
KMnO4) = 158,04/5 = 31,6 г/моль, в щелочной среде М(KMnO4) = 158,04; в нейтральной - М( KMnO4) = 158,04/3 = 52,68 г/моль.
KMnO4) = 158,04/3 = 52,68 г/моль.
Методы ОВ титрования называют по типу применяемого титранта. Наиболее широкое применение нашли следующие виды ОВ титрования: перманганатометрия – титрант KMnO4, йодометрическое - титранты растворы йода (J2) и тиосульфата натрия (Na2S2O3), броматометрическое (титрант КBrO3), бромометрическое (титрант Br2 (КBrO3 + KBr), дихроматометрическое (K2Cr2O7), церийметрическое - Се(SO4)2 и др.
Способы установления Т.Э.
Для определения точки эквивалентности при окислительно-восстановительном титровании используют:
а) безиндикаторные методы. В случае, когда раствор титруемого вещества или титранта имеют окраску, ТЭ можно определить по исчезновению или появлению этой окраски, соответственно;
б) специфические индикаторы – изменяющие цвет при появлении титранта или исчезновении определяемого вещества. Например, для системы J2/2J-, специфическим индикатором является крахмал, окрашивающий растворы, содержащие J2 в синий цвет, а для ионов Fe3+ специфическим индикатором являются ионы SCN- (ионы тиоцианата), образующийся комплекс окрашен в кроваво-краный цвет;
в) ОВ (редокс-) индикаторы – изменяющие цвет при изменении ОВ потенциала системы. Одноцветные индикаторы – дифениламин, двухцветные – ферроин.
Редокс – индикаторы существуют в двух формах – окисленной (Indок) и восстановленной (Indвосс), причем цвет одной формы отличается от другой. Переход индикатора от одной формы в другую и изменение его окраски происходит при определенном потенциале перехода, который наблюдается при равенстве концентраций окисленной и восстановленной форм индикатора и по уравнению Нернста –Петерса:

Интервал перехода редокс-индикаторов очень невелик в отличие от кислотно-основных индикаторов.
Кривые ОВ титрования
Кривые ОВ титрования ОВ изображают изменение ОВ потенциала системы по мере приливания раствора титранта.
Редуктометрия, когда раствор окислителя титруется стандартным раствором восстановителя
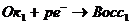
В редуктометрии кривые титрования рассчитывают:
1) 
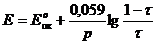
2) 
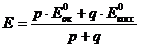
3) 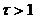
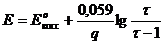

Оксидиметрия, когда раствор восстановителя титруется стандартным раствором окислителя
В оксидиметрии кривые титрования рассчитывают:
1) 

2) 
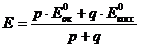
3) 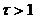
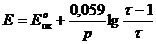

Пример. Рассчитаем кривую титрования 100 см3 раствора FeSO4 c молярной концентрацией эквивалента 0,1 моль/дм3 раствором КMnO4 такой же концентрации.
Уравнение реакции:

Константа равновесия этой реакции равна

Большое числовое значение константы равновесия показывает, что равновесие реакции практически целиком сдвинуто вправо. После добавления первых же капель титранта в растворе образуются две ОВ пары: 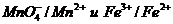 , потенциал каждой из которых можно вычислить по уравнению Нернста:
, потенциал каждой из которых можно вычислить по уравнению Нернста:
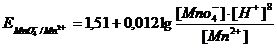
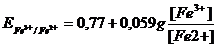
В данном случае раствор восстановителя титруется раствором окислителя, т.е. титрование относится к методу оксидиметрии, расчет кривой титрования проводим по соответствующей схеме.
1) До Т.Э. 




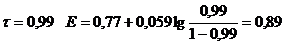

2) В Т.Э. 

3) После Т.Э. 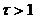
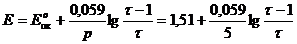
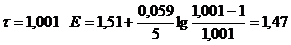
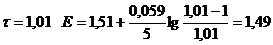


Расчетные данные для построения кривой титрования
| №
п/п
| τ
| Расчетная формула
| E, В
|
|
| 0,10
| 
| 0,71
|
| 0,50
| 0,77
|
| 0,90
| 0,83
|
| 0,99
| 0,89
|
| 0,999
| 0,95
|
|
|
| 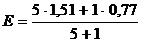
| 1,39
|
|
| 1,001
| 
| 1,47
|
| 1,01
| 1,49
|
| 1,10
| 1,50
|
| 1,50
| 1,505
|
По данным таблицы строим кривую титрования:
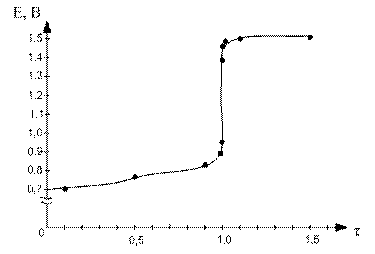
Для ошибки титрования ± 0,1 % скачок титрования
∆E = Eτ=1,001 - Eτ=0,999 = 1,47 – 0,95 = 0,52.
Для ошибки титрования ± 1,0 % скачок титрования
∆E = Eτ=1,01 - Eτ=0,99 = 1,49 – 0,89 = 0,60.
В области ТЭ при переходе от раствора недотитрованного на 0,1 % к раствору перетитрованному на 0,1 % потенциал изменяется больше, чем на 0,5 В. Скачок потенциала позволяет использовать для обнаружения ТЭ непосредственно потенциометрические измерения или ОВ индикаторы, окраска которых изменяется при изменении потенциала. Кроме того в этом случае в качестве титранта используется окрашенный раство, следовательно Т.Э. можно определить по появлению слабо-розовой окраски от одной избыточной капли перманганата калия.
ПЕРМАНГАНАТОМЕТРИЯ
В основе метода лежит окисление растворов восстановителей перманганатом калия КМnО4. Окисление восстановителей можно проводить в различных средах, причем марганец (VII) восстанавливается в кислой среде до ионов Мn2+, в нейтральной - до марганца (IV) и в щелочной - до марганца (VI). Обычно в методе перманганатометрии проводят реакцию в кислой среде. При этом протекает полуреакция

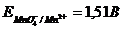
Титрованный раствор  по точной навеске приготовить нельзя, т.к. он содержит в своем составе
по точной навеске приготовить нельзя, т.к. он содержит в своем составе  . Поэтому сначала готовят раствор
. Поэтому сначала готовят раствор 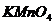 приблизительно нужной концентрации, оставляют в темной бутыли на 7-10 дней, отфильтровывают выпавший в осадок
приблизительно нужной концентрации, оставляют в темной бутыли на 7-10 дней, отфильтровывают выпавший в осадок  , а затем устанавливают точную концентрацию полученного раствора
, а затем устанавливают точную концентрацию полученного раствора 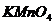 . Стандартизацию раствора
. Стандартизацию раствора 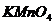 проводят по титрованному раствору щавелевой кислоты (
проводят по титрованному раствору щавелевой кислоты (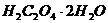 ) или оксалата натрия (
) или оксалата натрия ( ).
).

Индикатором служит сам перманганат, окрашенный в красно-фиолетовый цвет. Конец реакции легко определяется по изменению окраски от одной избыточной капли перманганата. В кислой среде титруемый раствор окрашивается в розовый цвет за счет избыточных МnО4- -ионов. Большим недостатком окислительно-восстановительных реакций является их небольшая скорость, что затрудняет процесс титрования. Для ускорения медленно идущих реакций применяют нагревание. Как правило, с повышением температуры на каждые 10° скорость реакции увеличивается в 2-3 раза. Реакцию окисления перманганатом щавелевой кислоты, проводят при температуре 70-80 °С. В этих условиях титрование проходит нормально, так как скорость реакции значительно увеличивается.
Если нагревание применять нельзя (улетучивание одного из веществ, разложение и т. д.), для ускорения реакции увеличивают концентрации реагирующих веществ. На скорость реакции может оказывать влияние введение в раствор катализатора.
Реакцию окисления перманганатом щавелевой кислоты можно каталитически ускорить прибавлением МnSО4, роль которого сводится к следующему:

Образовавшийся диоксид марганца окисляет щавелевую кислоту, восстанавливаясь до марганца (III):

Затем

Таким образом, прибавленный к раствору марганец (II) полностью регенерируется и на реакцию не расходуется, но сильно ускоряет реакцию. В перманганатометрии одним из продуктов реакции окисления щавелевой кислоты являются ионы Мn2+, которые по мере образования в растворе ускоряют процесс реакции. Такие реакции называют автокаталитическими. Первые капли перманганата при титровании горячего подкисленного раствора щавелевой кислоты обесцвечиваются медленно. По мере образования небольшого количества ионов Мn2+ дальнейшее обесцвечивание перманганата происходит практически мгновенно, так как образовавшиеся ионы Мn2+ играют роль катализатора.





 Существует связь между константой равновесия редокс-реакции К и разностью нормальных редокс-потенциалов DЕ0. Величину К вычисляют, исходя из ЭДС полной реакции
Существует связь между константой равновесия редокс-реакции К и разностью нормальных редокс-потенциалов DЕ0. Величину К вычисляют, исходя из ЭДС полной реакции 
 KMnO4) = 158,04/5 = 31,6 г/моль, в щелочной среде М(KMnO4) = 158,04; в нейтральной - М(
KMnO4) = 158,04/5 = 31,6 г/моль, в щелочной среде М(KMnO4) = 158,04; в нейтральной - М( KMnO4) = 158,04/3 = 52,68 г/моль.
KMnO4) = 158,04/3 = 52,68 г/моль.
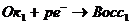

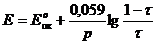

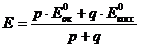
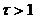
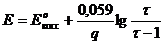



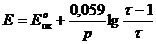



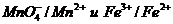 , потенциал каждой из которых можно вычислить по уравнению Нернста:
, потенциал каждой из которых можно вычислить по уравнению Нернста: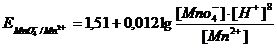
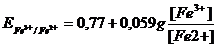




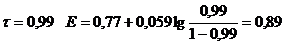


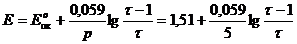
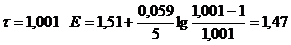
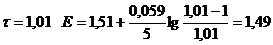



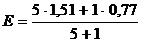



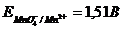
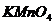 по точной навеске приготовить нельзя, т.к. он содержит в своем составе
по точной навеске приготовить нельзя, т.к. он содержит в своем составе  . Поэтому сначала готовят раствор
. Поэтому сначала готовят раствор 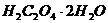 ) или оксалата натрия (
) или оксалата натрия ( ).
).






