ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ТЕПЛОТЕХНИКИ.
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Методические указания по выполнению лабораторных работ
Омск
Издательство ОмГТУ
Составители: В.П Белоглазов, канд. техн. наук, доцент,
Н.В. Кондратьев, канд. техн. наук.
Предназначено для студентов дневного, дистанционного и заочного обучения по специальностям 104101 «Тепловые электрические станции» и 104104
«Промышленная теплоэнергетика»
Печатается по решению редакционно-издательского совета
Омского государственного технического университета
ВВЕДЕНИЕ
Предлагаемые методические указания предназначены для предварительной подготовки студентов к проведению лабораторных работ по курсу. «Теоретические основы теплотехники» соответствующих разделов «Техническая термодинамика» для специальности «Тепловые электрические станции», «Промышленная теплоэнергетика» могут быть использованы и для курса «Теоретические основы теплотехники» не энергетических специальностей.
В методических указаниях даны цель работы, теоретическая часть, схема и описание экспериментальной установки, порядок проведения работы, ее оформление и порядок защиты. Даны рекомендации по содержанию отчета лабораторной работы.
Студент допускается к проведению лабораторной работы, если преподаватель убедится, что студент в полном объеме (с точки зрения теории и описания проведения эксперимента) готов к ее выполнению.
Лабораторная работа № 1
Определение удельной теплоемкости воздуха при постоянном давлении
Цель работы: экспериментальное определение теплоемкости воздуха при постоянном давлении.
Теоретические положения
Теплоемкостью тела называют количество теплоты, необходимое для изменения его температуры на 1 К.
В зависимости от того, в каких единицах задано количество вещества, в расчетах используют следующие удельные теплоемкости:
массовую теплоемкость c, отнесенную к 1 кг массы, Дж/(кг К);
молярную теплоемкость µс, отнесенную к 1 кмоль вещества, Дж/(кмоль К);
объемную теплоемкость с’, отнесенную к количеству вещества, содержащемуся в 1 м3 при нормальных физических условиях, Дж/(нм3 К).
Массовая теплоемкость в процессе при постоянном давлении обозначается ср и называется изобарной, а в процессе при постоянном объеме сv – изохорной.
Согласно уравнения Майера: ср – сv = R. R – удельная газовая постоянная представляет собой работу расширения 1 кг газа при его нагреве на 1 К при постоянном давлении.
Схема и описание лабораторной установки
Схема экспериментальной установки приведена на рис.1. На передней панели находится двухканальный измеритель температур (5) 2ТРМО, подключённый к двум хромель-копелевым термопарам t1 и t2 рис.2, источник питания постоянного тока (3), ротаметр (4), тумблер «Сеть», тумблёр включения компрессора (2), разъемы (8) для подключения вольтметра (мультиметра) (9), переключатель (7) для измерения напряжения Uн на нагревателе и падения напряжения Uо на образцовом сопротивлении Rо.
На рис.2 приведена схема рабочего участка. Воздух при температуре t1 подаётся компрессором (11) через холодильник (12) и ротаметр (13) по трубке (14), покрытой тепловой изоляцией (17), в сосуд Дьюара (15). В трубке (14) находится нихромовый нагреватель (16) к которому последовательно подключено образцовое сопротивление Ro = 0,1 Ом. Протекая через трубку (14), воздух нагревается. Нагреватель питается от плоемкостью тока (ИП). Напряжение на нагревателе Uн и напряжение на образцовом сопротивлении Uо измеряется вольтметром (мультиметром). Температура воздуха на входе в сосуд Дьюара t1 и температура воздуха на выходе t2 из трубки (14) после нагрева измеряется прибором 2ТРМО. Объёмный расход воздуха G измеряется ротаметром (13).
Проведение опытов и обработка результатов измерений
1. Включить питание установки тумблером «Сеть», измеритель температуры (5) тумблером (6), компрессор тумблером (2).
2. Включить питание нагревателя кнопочным выключателем (3) источника питания и установить первое значение напряжения Uн = 3 В.
3. Включить мультиметр и измерить точное значение Uн и Uо, переключая тумблер (7) в соответствующие положения.
4. Через 2 – 3 минуты (по достижении стационарного режима) произвести отсчёт температур t1 и t2 по измерителю 2ТРМО и объёмного расхода воздуха V по ротаметру (4).
5. Пункты 3 – 5 повторить для следующих значений напряжения на нагрева-теле: Uн = 4; 5; 6; 7 В.
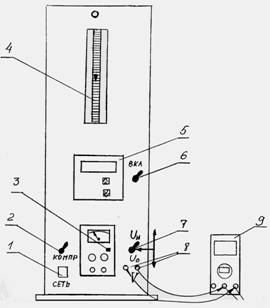
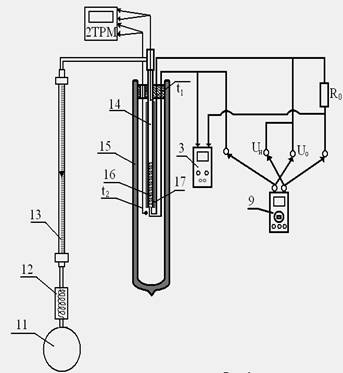
Рис. 1. Схема экспериментальной установки. Рис. 2. Схема рабочего участка.
Измеренные величины:
t2 – температура холодного воздуха на входе в сосуд Дьюара в °С;
t1 – температура нагретого воздуха на выходе из сосуда Дьюара в °С;
V – объёмный расход нагреваемого воздуха м3/с;
Uн – напряжение на нагревателе, В;
Uо – напряжение на образцовом сопротивлении, мВ.
Расчётные величины:
Массовый расход воздуха:
G= V ρв
где rв – плотность воздуха на входе в компрессор при нормальных условиях
rв = 1,29 кг/м3.
Ток в нагревателе
I = Uо/ Rо
величина образцового сопротивления: R0 = 0,1 Ом;
Тепло, выделяемое нагревателем и передаваемое воздуху;
Q = Uн I
Зная температуры до и после передачи воздуху тепла от нагревателя, а так же его расход, можно определить теплоёмкость воздуха при постоянном давлении.

Показания приборов во время опытов (измеренные величины) и расчетные величины следует записать в таблицу
Таблица
| № п/п
| t1 °С
| t2 °С
| Uн, В
| Uо, мВ
| I, A
| Q, Вт
| V, м3/ч
| срm
Дж/кг×К
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Содержание отсчета
В отчет должны быть включены:
1) схема и описание лабораторной установки;
2) порядок проведения работы, основные теоретические положения;
3) таблица наблюдений и расчет средней массовой изобарной теплоемкости срm на основании опытных данных;
4) определение через срm теплоемкостей с’pm, mсpm, сvm, с’vm, mсvm в системе СИ;
5) ответы на контрольные вопросы.
Контрольные вопросы.
1. Как связаны между собой мольная, массовая и обьемная теплоемкости?
2. Что такое массовая, обьемная, средняя и мольная теплоемкости?
3. В чем разница между истинной и средней теплоемкостями?
4. Как связаны между собой изохорная и изобарная теплоемкости?
Лабораторная работа № 2
Обработка результатов
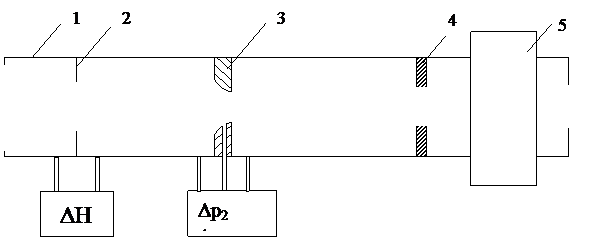
1. ВычислитьD Н = H1-Н2
2. ВычислитьD h = h1-h2
3. Показатель адиабаты
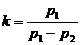
где р1 - давление в баллоне после закачивания компрессором в него воздуха;
р2 – давление в баллоне после резкого открытия клапана 4.
С учетом того что р1 = rgDH и р2 = rgDh
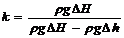 .
.
После сокращений расчетная формула для определения k принимает вид
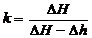 .
.
4. Сравнить результат эксперимента с табличными данными показателя адиабаты для воздуха k = 1,29, определить расхождение в процентах.
5. Результаты измерений и расчетов заносятся в таблицу.
Таблица
| №
| H1,
мм
| H2,
мм
| DН,
мм
| h1,
мм
| h2,
мм
| Dh,
мм
| k
| Dk
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Содержание отсчета
В отчет должны быть включены:
1) схема и описание лабораторной установки;
2) порядок проведения работы, основные теоретические положения;
3) таблица наблюдений и расчет показателя адиабаты;
4) ответы на контрольные вопросы.
Контрольные вопросы
1. Что такое адиабатный процесс?
2. Чем адиабатный процесс отличается от политропного процесса?
3. Что такое политропный процесс?
4. Запишите уравнения адиабатного и политропного процессов?
5. Назовите частные случаи политропного процесса? Запишите уравнения для каждого из них.
6. Приведите пример адиабатного процесса?
Лабораторная работа № 3
ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ГАЗОВОЙ
ПОСТОЯННОЙ ВОЗДУХА
Цель работы: экспериментальное определение газовой постоянной воздуха.
Теоретические основы работы
Величины, характеризующие физические состояния газа, называются термодинамическими параметрами.
Основными параметрами являются: удельный объем, плотность, давление и температура.
Давление – сила воздействия молекул газа на единицу площади поверхности. В системе си давление измеряется в н/м2, эта единица называется Паскалем (Па). На практике использую так же величины кратные Па: килопаскаль (1 кПа = 103 Па), мегапаскаль (1 МПа = 106 Па) и (1 бар = 105 Па). В технике часто используются внесистемные единицы давления: техническая атмосфера (1 кгс/см2), физическая атмосфера, мм ртутного столба.
Соотношения между этими единицами давления следующие:
1 техническая атмосфера (ат.) = 1 кгс/см2 = 735 мм рт. ст. = 0,981×105 Па.
1 физическая атмосфера (атм.) = 1,033 кгс/см2 = 760 мм рт. ст. = 1,013×105 Па.
Давление измеряют манометром.
Различают атмосферное давление (барометрическое) В, абсолютное давление Рабс, избыточное Ризб и вакуум (разряжение).
Если абсолютное давление в каком либо сосуде больше атмосферного
Рабс > В то разность между ними называют избыточным давлением
Рабс – В = Ризб
Если абсолютное давление в каком либо сосуде меньше атмосферного
Рабс < В то разность между ними называют вакуумом (разряжением)
В – Рабс = W.
Во все термодинамические уравнения вводится абсолютное давление в (Па).
Температура – мера интенсивности теплового движения молекул. Температура измеряется в кельвинах Т (К) или в градусах Цельсия t (°С), соотношение между ними имеет следующий вид:
Т [K]= t [°С]+ 273,15.
Удельный объем – объем который занимает один килограмм газа
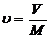 ,
,
где V – объем газа, м3; М – масса газа, кг; u - удельный объем, м3/кг.
Удельный объем газа может принимать любое значение в зависимости от давления и температуры.
Плотность – масса единицы объема, т.е. величина обратная удельному
объему r, кг/м3
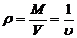
Связь между параметрами состояния идеального газа определяется уравнением состояния (Клапейрона)
рu = RТ
где R – газовая постоянная, Дж/(кг×К).
Газовая постоянная R индивидуальна для каждого газа.
Для воздуха R = 287 Дж/(кг×К).
Если левую и правую часть уравнения состояния умножить на массу М, то получим уравнение Клапейрона для произвольной массы
рV = MRТ.
Содержание отсчета
В отчет должны быть включены:
1) схема и описание лабораторной установки;
2) порядок проведения работы, основные теоретические положения;
3)таблица наблюдений и расчетные данные;
4) ответы на контрольные вопросы.
Контрольные вопросы
1. Что такое удельная газовая постоянная?
2. Приведите связь удельной газовой постоянной с удельными теплоемкостями?
3. Что такое универсальная газовая постоянная?
4. Запишите уравнения связи универсальной газовой постоянной с показателем адиабаты идеального газа?
5. Приведите связь удельной газовой постоянной с молярными теплоемкостями
Лабораторная работа № 4
Давление насыщенного пара
давление, которое может оказывать водяной пар при определенной температуре (максимально возможное значение давления пара), [Па]. Так как поглощающая способность воздуха увеличивается с повышением температуры, то давление насыщенного пара также увеличивается;
Точка росы
температура газа, при которой газ насыщается водяным паром °C при постоянном влагосодержании. Относительная влажность газа при этом составляет 100 %. С дальнейшим притоком водяного пара или при охлаждении воздуха (газа) появляется конденсат. Таким образом, хотя роса и не выпадает при температуре
−10 или −50°C, выпадает изморозь, иней, лёд или снег, точка росы в −10 или −50 °C существует и соответствует 2,361 и 0,063 г воды на 1м³ воздуха или другого газа под давлением одна атмосфера;
Удельная влажность
вес водяного пара в граммах на килограмм увлажненного воздуха [г/кг], то есть отношение масс водяного пара и увлажненного воздуха;
Содержание отчета
В отчет должны быть включены:
1) схема и описание лабораторной установки;
2) порядок проведения работы, основные теоретические положения;
3) таблица наблюдений и расчетные данные.
4) ответы на контрольные вопросы.
Контрольные вопросы.
1. Что такое влажность?
2. Что такое относительная влажность воздуха?
3. Что такое точка росы?
4. Что такое температура мокрого термометра?
5. Что такое парциальное давление пара?
Лабораторная работа № 5
Теоретические основы работы
При расчете истечения газа через сопла (рис.), определяется скорость истечения и расход. Для чего находится отношение р3/р1, где р3 – давление среды на выходе из сопла; р1 – давление среды на входе в сопло.
Полученное числовое значение сравнивают с критическим отношением давлений для данного газа
 .
.
Для одноатомного газа при k = 1,67
bкр = 0,487;
для двухатомного газа при k = 1,4
bкр = 0,528;
для трех- и многоатомного газа при k = 1,29
bкр = 0,546.
Если адиабатное истечение газа происходит при
(р3/р1) > bкр ,
то теоретическая скорость газа в устье сопла определится по формуле
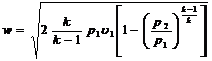 ,
,
где k – показатель адиабаты; u1 – удельный объем газа на входе в сопло.
Расход газа
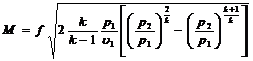 ,
,
где f – выходной диаметр сопла в м2.
Если истечение газа происходит при
(р3/р1) < bкр ,
то теоретическая скорость газа в устье сопла будет равна критической скорости и определится по формуле
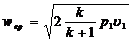 ,
,
расход газа в этом случае будет максимальным
 .
.
Описание лабораторной установки и порядок проведения опыта
В работе используется метод имитационного моделирования действительных процессов течения различных газов в канале. Установка включает в себя (рис.) трубу 1, мерную диафрагму 2, сопло 3, регулятор потока 4, вентилятор 5.
Рис. Схема лабораторной установки
Движение потока газа через сопло создается с помощью вентилятора. Начальное давление р1 перед соплом равно атмосферному, а давление р3 за соплом регулируется регулятором потока 4. При этом одновременно изменяются скорость истечения газа и его расход. Выходной диаметр сопла равен 1,5 мм, диаметр диафрагмы – 5 мм.
В ходе проведения опыта при различных скоростях течения газа фиксируются значения падения давления на мерной диафрагме DН, изменение давления в выходном сечении сопла Dр2 и за соплом Dр3. Результаты эксперимента записываются в протокол наблюдений и расчетов (табл.).
Абсолютное давление на срезе сопла
р2 = р1 - Dр2
за соплом –
р3 = р1 - Dр3.
Отношение давлений газа за соплом и перед ним
b = р3/р1
Таблица 6
Значения измеряемых и расчетных величин
| Газ
| Измеряемые величины
| Расчетные величины
|
| DН
Па
| Dр2
кгс/см2
| Dр3
кгс/см2
| р2
Па
| р3
Па
| b
| w
м/с
| МД
кг/с
| М
кг/с
| mС
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Действительный массовый расход газа

 ,
,
где mД = 0,95 – коэффициент расхода мерной диафрагмы; fД – площадь сечения диафрагмы; r1 – плотность исследуемого газа при нормальных условиях.
Коэффициент расхода сопла
 .
.
Содержание отчета
В отчет должны быть включены:
1) схема и описание лабораторной установки;
2) Основные теоретические положения
3) расчетные формулы;
4) таблицы наблюдений и расчетов;
5) график зависимости теоретического и действительного расхода от коэффициента bкр
6) ответы на контрольные вопросы.
Контрольные вопросы
1. Какие режимы истечения газов из сопел существуют?
2. Почему скорость истечения газа из суживающего сопла не может превысить скорость звука?
3. От чего зависит значение bкр?
4. В чем отличие между теоретической и действительной скоростью истечения.
5. На основании уравнения профиля канала проанализируйте изменения скорости звука в потоке и скорости истечения газа для сопла Лаваля.
Лабораторная работа № 6
Расчётные формулы.
Процесс нагрева воздуха в ёмкости с постоянным объёмом можно описать законом Шарля. Для двух состояний газа запишем
p1 = pO (1 + a t1); p2 = pO (1 + a t2), (1)
где: р1 и р2 – давление воздуха в ёмкости в первом и втором термодинамическом состоянии; рО – давление воздуха пари нормальных условиях;  - температурный коэффициент давления.
- температурный коэффициент давления.
Из соотношений (1), исключая pO, получим выражение для термического коэффициента давления
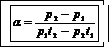 . (2)
. (2)
Для указанных двух состояний, величины давлений воздуха в ёмкости можно определить по положению мениска в герметизированном колене манометра Н1 и Н2. При этом предполагается, что уровень жидкости в герметизированном колене манометра ниже на 4-5 см, чем уровень в колене, соединённым с ёмкостью. На основании этого можно записать
p1 = p/1 - r g H1; p2 = p/2 - r g H2, (3)
где p/1 и p/2 – давление воздуха в закрытом колене манометра;
H1 и H2 – разность уровней воды (или масла) в манометре;
r – плотность воды (или масла); 
g – ускорение силы тяжести.
Для воздуха, находящегося в закрытом колене манометра при постоянной температуре в лаборатории можно применить закон Бойля-Мариотта, который для наших двух состояний запишется в виде
p/1 h1 = p/2 h2 ,(4)
где h1 и h2 – высота столба воздуха в закрытом колене манометра в первом и втором состоянии соответственно.
Из уравнений (1), (3) и (4) можно определить температурный коэффициент давления
 . (5)
. (5)
Если пренебречь первым слагаемым, то из (5) следует
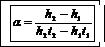 . (6)
. (6)
Содержание отсчета
В отчет должны быть включены:
1) схема и описание лабораторной установки;
2) порядок проведения работы, основные теоретические положения;
3) таблица наблюдений и расчетные данные;
4) ответы на контрольные вопросы.
Контрольные вопросы.
1. О чем говорит закон?
2. В чем смысл закона Бойля-Мариотта?
3. Что такое универсальная газовая постоянная?
4. Закон Шарля говорит о том, что…?
5. Приведите закон Клапейрона
Общие рекомендации по содержанию отчета
Отчет по каждой лабораторной работе должен содержать:
а) цель работы;
б) краткое описание математической модели процесса;
в) схему экспериментальной установки;
г) результаты проведенных исследований в виде таблиц и графиков;
д) ответы на контрольные вопросы;
е) выводы: содержать краткую аннотацию 2-3 предложения по теме проведенного исследования, где отражается место работы в теории, значимость, полнота проведенного исследования и свои замечания по конкретному проведению лабораторной работы.
Отчет оформляется в отдельной тетради, в которую добавляются последующие отчеты. Отчет должен быть защищен до проведения следующей работы. Каждый отчет подписывается ведущим преподавателем, который в итоге делает заключение о допуске студента к сдаче экзамена (зачета).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Теплоэнергетика и теплотехника: Справочник. Т1 / Под ред. Григорьева В.А., Зорина В.М. М.: Энергия, 1980.
2. Нащокин В.В. Техническая термодинамика и теплопередача: М.: Высшая школа, 1980.
3. Новиков И.И. Термодинамика. М.: Машиностроение, 1984.
Редактор О.В. Есаулов
Компьютерная верстка Т.А. Бурдель
ИД № 06039 от 12.10.01
Сводный темплан 2008 г.
Подписано в печать 7.06.08. Формат 60х84 1/6.
Отпечатано на дупликаторе. Усл. печ.л.2,0. Уч.-изд.л. 2,0.
Тираж 150. Заказ 416.
Издательство ОмГТУ. 644050, г. Омск, пр. Мира, 11
Типография ОмГТУ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ТЕПЛОТЕХНИКИ.
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Методические указания по выполнению лабораторных работ
Омск
Издательство ОмГТУ
Составители: В.П Белоглазов, канд. техн. наук, доцент,
Н.В. Кондратьев, канд. техн. наук.
Предназначено для студентов дневного, дистанционного и заочного обучения по специальностям 104101 «Тепловые электрические станции» и 104104
«Промышленная теплоэнергетика»
Печатается по решению редакционно-издательского совета
Омского государственного технического университета
ВВЕДЕНИЕ
Предлагаемые методические указания предназначены для предварительной подготовки студентов к проведению лабораторных работ по курсу. «Теоретические основы теплотехники» соответствующих разделов «Техническая термодинамика» для специальности «Тепловые электрические станции», «Промышленная теплоэнергетика» могут быть использованы и для курса «Теоретические основы теплотехники» не энергетических специальностей.
В методических указаниях даны цель работы, теоретическая часть, схема и описание экспериментальной установки, порядок проведения работы, ее оформление и порядок защиты. Даны рекомендации по содержанию отчета лабораторной работы.
Студент допускается к проведению лабораторной работы, если преподаватель убедится, что студент в полном объеме (с точки зрения теории и описания проведения эксперимента) готов к ее выполнению.
Лабораторная работа № 1







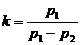
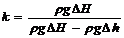 .
.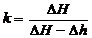 .
.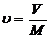 ,
,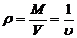
 .
.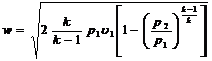 ,
,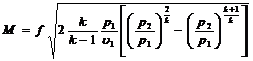 ,
,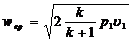 ,
, .
.

 ,
, .
. - температурный коэффициент давления.
- температурный коэффициент давления.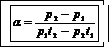 . (2)
. (2)
 . (5)
. (5)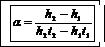 . (6)
. (6)



