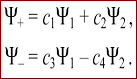при описании строения многоэлектронных атомов необходимо
учитывать взаимодействие электрона не только с ядром,
но и с другими е
возникает проблема последовательности
заполнения е различных подуровней в атоме
последовательностьопределяется
тремя « правилами »
Принцип Паули (принцип запрета) — один из фундаментальных принципов квантовой механики.
• В одном атоме не может быть двух электронов с одинаковыми
наборами значений всех четырех квантовых чисел
• Первые три квантовых числа характеризуют орбиталь,
на которой находится е
• если два е имеют одинаковый их набор, то, в соответствии
с принципом Паули они должны отличаться значением спина
Правило Хунда(Гунда) определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двух электронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел 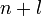 . При одинаковой сумме раньше заполняется орбиталь с меньшим значением
. При одинаковой сумме раньше заполняется орбиталь с меньшим значением 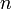 .
.
7. Химическая связь. Природа химической связи и ее параметры. Перекрывание АО с образованием σ- и π-связей.
Химическая связь осуществляется s- и p-электронами
внешнего и d-электронами предвнешнего слоя и характеризуется
следующими параметрами:
• Длиной связи – межъядерным расстоянием между двумя химически
связанными атомами
• Валентным углом – углом между воображаемыми линиями,
проходящими через центры химически связанных атомов
• Энергией связи – количеством энергии, затрачиваемой на ее
разрыв в газообразном состоянии
• Кратностью связи – числом электронных пар, посредством
которых осуществляется химическая связь между атомами.
Область между ядрами называется связывающей, т. к.
при нахождении там е образуется химическая связь.
Область, находящаяся за ядрами, называется разрыхляющей,
т. к. при попадании в нее е химическая связь не образуется.
В молекуле Н2 появляется второй е, что еще больше стабилизирует систему для образования устойчивой химической связи необходима,
по меньшей мере, одна электронная пара, спины е в этом случае должны быть антипараллельны, т. е. направлены в разные стороны.
Образование химической связи должно сопровождаться понижением полной Е системы.
Для возникновения ХС необходимо перекрывание частей электронных оболочек с одинаковым знаком ψ.
В противном случае химическая связь не образуется.
В зависимости от симметрии перекрывающихся электронных облаков,
суммарное электронное облако будет иметь различную симметрию.
Различают 3 вида: s, p и d- связи.
σ-связь:
1) Образуют S- и р - электроны
2) Имеет цилиндрическую симметрию
3) Имеют один максимум электронной плотности
S-Электроны образуют s-связь в результате перекрывания со следующими электронами другого атома:
s–, pX–, dx2-y2 – электронами.
Когда происходит перекрывание в областях, где электронная плотность
имеет противоположные знаки – образуется не связывающая орбиталь.
π-связи:
1) возникают при перекрывании электронных облаков над и под
линией, соединяющей центры атомов.
2) Не имеют цилиндрической симметрии
3) Имеют 2 максимума электронной плотности
π-связь образуют электроны на таких парах орбиталей
как pY – pY, pZ – pZ, py – dXY
8. Метод молекулярных орбиталей. МО-ЛКАО на примере молекулы водорода. Волновые функции для связывающей и разрыхляющей МО
Условия:
1. метод МО химическую связь рассматривает как многоцентровую и многоэлектронную
2. для приближенного решения уравнения Шредингера волновая функция, соответствующая МО, задается как линейная комбинация атомных орбиталей (МО ЛКАО)
сумма 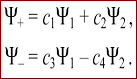
И разность
атомных волновых функций с коэффициентами, указывающими на долю их вклада в образование МО.
Связывающие и разрыхляющие молекулярные орбитали.
Связывающая МО образуется при сложении атомных орбиталей, ее
энергия понижается относительно энергий АО.
Волновая функция, соответствующая связывающей орбитали,
получается в результате сложения волновых функций с одинаковым
знаком.
Электронная плотность при этом концентрируется между ядрами,
и волновая функция принимает положительное значение.
При вычитании атомных орбиталей энергия МО повышается –
образуется разрыхляющая орбиталь. Электронная плотность
располагается за ядрами, а между ними равна нулю.
Волновая функция в двух образовавшихся электронных облаках
имеет противоположные знаки
правила:
1. Электроны в молекуле, как и в атоме, занимают соответствующие
орбитали, характеризующиеся своим набором квантовых чисел;
2. Число образующихся МО равно числу АО, участвующих в их образовании;
3. Распределение электронов по МО подчиняется принципу наименьшей
энергии (Клечковского), принципу Паули и правилу Хунда;
4. Для гомоядерных молекул выигрыш в энергии за счет образования
связывающей орбитали компенсируется повышением энергии
разрыхляющей орбитали
5. В гетероядерных (разно элементных) молекулах связывающие орбитали
по энергии ближе к орбиталям более электроотрицательного атома (B),
а разрыхляющие – к орбитали менее электроотрицательного атома (A)
6. Кратность химической связи равна половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов на разрыхляющих.
9.Типы орбиталей. Схемы образования σ- и π- молекулярных орбиталей. Условия образования связывающей, не связывающей и разрыхляющей МО в рамках метода МО.
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии. s-Орбитали имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
S-орбитали
Орбитальному квантовому числу l = 0 соответствует единственное значение магнитного квантового числа ml = 0. Эти значения характеризуют все s-орбитали.
т. к. в этом случае магнитное квантовое число принимает только
одно значение, каждый s-подуровень состоит только
из одной орбитали.

Р-орбитали
• Рассмотрим любой p-подуровень: при l = 1
• орбитали имеют форму гантелей (объемные «восьмерки»),
• магнитное квантовое число принимает следующие значения ml = – 1, 0, + 1 (три значения), следовательно,
• p-подуровень состоит из трех орбиталей, и эти орбитали располагаются вдоль трех осей координат и, соответственно, обозначаются px, py, pz

D-орбитали
Для d-подуровня
l = 2, ml = – 2, – 1, 0, + 1, + 2 (5 значений), и любой
d-подуровень состоит из 5 орбиталей, которые определенным
образом расположены в пространстве и соответственно
обозначаются dxy, dxz, dzy, dz2 и dx2-y2

σ-связь:
1) Образуют S- и р - электроны
2) Имеет цилиндрическую симметрию
3) Имеют один максимум электронной плотности
S-Электроны образуют s-связь в результате перекрывания со следующими электронами другого атома:
s–, pX–, dx2-y2 – электронами.
Когда происходит перекрывание в областях, где электронная плотность
имеет противоположные знаки – образуется не связывающая орбиталь.
π-связи:
1) возникают при перекрывании электронных облаков над и под
линией, соединяющей центры атомов.
2) Не имеют цилиндрической симметрии
3) Имеют 2 максимума электронной плотности
π-связь образуют электроны на таких парах орбиталей
как pY – pY, pZ – pZ, py – dXY
Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул.
Связывающая МО образуется при сложении атомных орбиталей, ее
энергия понижается относительно энергий АО.
Волновая функция, соответствующая связывающей орбитали,
получается в результате сложения волновых функций с одинаковым
знаком.
Электронная плотность при этом концентрируется между ядрами,
и волновая функция принимает положительное значение.
При вычитании атомных орбиталей энергия МО повышается –
образуется разрыхляющая орбиталь. Электронная плотность
располагается за ядрами, а между ними равна нулю.
Волновая функция в двух образовавшихся электронных облаках
имеет противоположные знаки
Не связывающая орбиталь
Образуется, когда АО одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с АО другого атома. ОНА переходит в энергетическую схему МО молекулы с энергией, соответствующей ей в атоме.



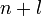 . При одинаковой сумме раньше заполняется орбиталь с меньшим значением
. При одинаковой сумме раньше заполняется орбиталь с меньшим значением 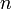 .
.