Действие постоянного электрического тока на ткань сопровождается изменением ее возбудимости


Различают 3 вида физиологического электротона или изменения возбудимости:
Катэлектротон - изменение возбудимости под катодом.
В момент замыкания под катодом формируется деполяризация и возбудимость повышается.
По мере удаления от катода количество его "-" зарядов, а следовательно и выраженность деполяризации уменьшается.
В результате возбудимость уменьшается, но она остается выше, чем в состоянии покоя
Анэлектротон - изменение возбудимости под анодом.
В момент замыкания под анодом формируется гиперполяризация и возбудимость снижается.
По мере удаления от анода количество его "+" зарядов, а, следовательно, и гиперполяризация уменьшается.
В результате возбудимость увеличивается, но она остается ниже, чем в состоянии покоя
Периэлектротон - обратное изменение возбудимости вне электротонических областей.
В зоне прекращения действия катода возбудимость снижается.
В зоне прекращения влияний анода она, наоборот, увеличивается
При длительном прохождении постоянного тока через ткань происходит извращение измененной возбудимости
При длительном замыкании под катодом происходит:
· инактивация Na проницаемости
·повышение уровня критической деполяризации
·увеличение порога деполяризации
· снижение вначале повышенной возбудимости
Это явление получило название катодическая депрессия
При длительном замыкании под анодом происходит:
· снижение К проницаемости
·уровень критической деполяризации снижается
·порог деполяризации уменьшается
· повышается вначале сниженная возбудимость
Это явление получило название анодическая экзальтация
Этот закон необходимо учитывать в медицинской практике
С одной стороны, он может быть использован, если требуется заблокировать проведение возбуждения по нервной или мышечной ткани (катодическая депрессия) или повысить возбудимость (анодическая экзальтация)
С другой стороны, необходимо помнить о возможности привыкания к длительному действию раздражителей, в частности, фармацевтических препаратов, влияющих на возбудимость мембраны.
ФИЗИОЛОГИЯ МЫШЦ И НЕРВОВ
Структура миофибрилл и ее изменения при сокращении. Миофибриллы представляют собой сократительный аппарат мышечного волокна. В поперечнополосатых мышечных волокнахмиофибриллы-разделены на правильно чередующиеся участки (диски), обладающие разными оптическими свойствами. Одни участки анизотропны, т. е. обладают двойным лучепреломлением. В обыкновенном свете они ^выглядят темными, а. в поляризованномг— прозрачными в продольном направлении й непрозрачными в поперечном. Другие участки в Обыкновенной свете выглядят светлыми — они изотропны, т. е. не; обладают двойным' лучепреломлением (рис. 34, а). Анизотропные участки обозначают буквой А, изотропные — буквой I. В середине диска А различается светлая полоска Н, посередине диска / — темная "полоска -представляющая собой тонкую мембрану, сквозь поры которой проходятмиофибриллы. Благодаря наличию этой опорной структуры параллельно расположенные однозначные диски отдельных фибрилл внутри одного волокна во время сокращения не смещаются по,отношению друг к другу.
Современные представления о структуре миофибриллярного аппарата основываются на исследованиях структуры мышечного волокна-при помощи электронной микроскопии, рентгеноструктурного анализа, фазово-контрастной и интерференционной микроскопии в сочетании с гистохимическими методами.
Установлено, что каждая миофибрилла мышечного волокна диаметром около 1 мкм состоит в среднем из 2500 протофибрилл, представляющих собой удлиненные полимери-, зованные молекулы белков миозина и актина; Миозиновые протофибриллы, или, как, их принято обозначать, нити, вдвое толще актиновых. Их диаметр,примерно 10 нм. В состоянии покоя мышечного волокна нити расположены в миофибрилле таким образом, ^что тонкие длинные актиновые нити входят своими концами в промежутки между толстыми и более короткими миозиновыми нитями (рис. 34, б). Благодаря этому диски / состоят только из актиновых нитей, а диски А — из нитей миозина, а, возможно, еще и другого белка.


Рис. 34. Структура миофибриллы (схема), Показаны диски А и 1-полоски Zи Н(а). Взаимное расположение толстых (миозиновых) и тонких; (актиновых) нитей в расслабленной (б) й сокращённой (в) миофибрилле.
Светлая полоска Н представляет собой узкую зону, свободную от актиновых нйтей. Мембрана Z, проходя через середину диска /, скрепляет,между собой эти Нити. Важным компонентом ультрамикроскопической-структуры миофибрилл являются также многочисленные поперечные мостики,.соединяющие между собой миозиновые и актиновые нити. При сокращений мышечного волокна указанные нити не укорачиваются, а начинают «скользить» друг по другу: актиновые нити вдвигаются в промежутки между миозиновыми, в результате чего диски / укорачиваются, а диски/1 сохраняют свой размер. Почти исчезает светлая полоска //, так как актиновые нити при сокращении сближаются друг с другом своими концами (рис. 34, в). Причиной «скольжения» является химическое взаимодействие между актином и миозином в присутствии ионов Са2+и АТФ. Наблюдается своегородачхимическое «зубчатое колесо», как 6^,1 протягивающее одну Группу нитей по другой. Роль «зубчиков» в этом процессе приписывают поперечным мостикам, обеспечивающим взаимодействие активных центров белков миозиновых и актиновых нитей.
Молекула актина
Это глобулярный белок, состоящий из одного полипептида, который полимеризуется с другими молекулами актина и образует две цепи, обвивающие друг друга (рис. 4-4 А). Такая двойная спираль представляет собой остов тонкого филамента. На каждой молекуле актина есть участок связывания миозина. В покоящемся мышечном волокне взаимодействие между актином и миозином предотвращают два белка - тропонин и тропомиозин (рис. 4-4 Б).
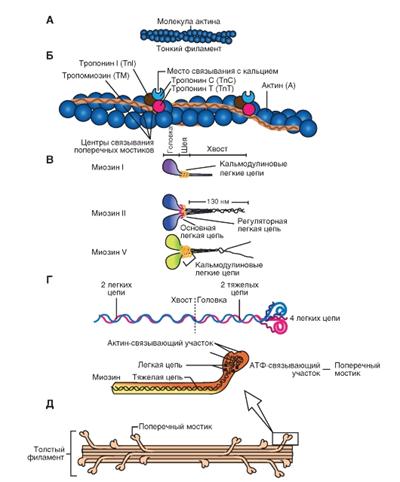
Тропомиозин - стержневидная молекула из двух полипептидов, обвивающихся друг около друга; молекула соответствует в длину примерно семи мономерам актина. Цепи из молекул тропомиозина, уложенные конец в конец, располагаются вдоль всего тонкого филамента. Молекулы тропомиозина частично прикрывают участки связывания каждой молекулы актина, мешая контакту миозина с актином. В таком блокирующем положении молекула тропомиозина удерживается тропонином.
Тропонин - гетеротримерный белок. Он состоит из тропонина Т (отвечает за связывание с одиночной молекулой тропомиозина), тропонина С (связывает ион Са2+) и тропонина I (связывает актин и ингибирует сокращение). Каждая молекула тропомиозина связана с одной гетеротримерной молекулой тропонина, которая регулирует доступ к участкам связывания миозина на семи мономерах актина, прилегающих к молекуле тропомиозина.
Миозин
Это единое название большой семьи протеинов, имеющих определенные отличия в клетках разных тканей. Миозин присутствует у всех эукариотов. Около 60 лет назад было известно два типа миозина, которые сейчас называют миозин I и миозин II. Миозин II был первым из числа открытых миозинов, и именно он принимает участие в мышечном сокращении. Позднее были открыты миозин I и миозин V (рис. 4-4 В). В последнее время показано, что миозин II участвует в мышечном сокращении, тогда как миозин I и миозин V вовлечены в работу подмембранного (кортикального) цитоскелета. В настоящее время идентифицировано более 10 классов миозина. На рисунке 4-4 Г показано два варианта схемы строения миозина, который состоит из головки, шейки и хвоста. Молекула миозина состоит из двух больших полипептидов (тяжелых цепей) и четырех меньших (легких цепей). Эти полипептиды составляют молекулу с двумя глобулярными «головками», которые содержат оба вида цепей, и длинным стержнем («хвостом») из двух переплетенных тяжелых цепей. Хвост каждой молекулы миозина располагается вдоль оси толстого филамента, а две глобулярные головки выступают по бокам, их иначе называют поперечными мостиками. На каждой глобулярной головке находятся по два участка связывания: для актина и для АТФ. Участки связывания АТФ обладают также свойствами фермента АТФазы, гидролизующей связанную молекулу АТФ.
Современное представление о











