Теоретическое введение.
Газификация твердого углерода протекает в ряде металлургических процессов (доменном, прямого получения железа и др.). Взаимодействие твердого углерода с диоксидом СО2 осуществляется по обратимой реакции:
С+СО2↔2СО; DНº>0, (1)
Константа равновесия реакции выражается соотношением:
КР=p2СО/ pСО2·αС, (2)
где: p2СО/ pСО2-равновесные давления соответствующих газов;
αС- активность углерода.
Константу равновесия изучаемой реакции можно рассчитать, зная состав равновесной газовой смеси СО-СО2:
КР=[100-(% СО2)]2·pоб/100·(% СО2), (3)
где: pоб- общее давление в системе.
1-1,013·105Па; 2 - 0,304·105Па
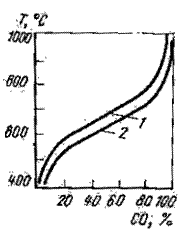
Рисунок 1-Равновесные содержания монооксида углерода для реакции С+СО2↔2СО в зависимости от температуры и давления
Реакция газификации углерода протекает с поглощением тепла и увеличением числа молей газообразных продуктов. В соответствии с принципом смещения равновесия повышение температуры и уменьшение давления в системе способствуют обогащению газовой фазы монооксидом СО (рисунок 1). Величина теплового эффекта реакции и состав газовой фазы изменяются в зависимости от разновидностей углерода, имеющих различную активность αС. Стабильной модификацией углерода является графит, для которого активность углерода принята равной единице. Так называемый аморфный углерод (кокс, деревянный кокс, сажа), представляющий собой высокодисперсный графит, обеспечивает получение газовой фазы, более богатой монооксидом СО. Повышенная активность аморфного углерода (αС>1) обусловлена добавочной величиной его поверхностной энергии.
В соответствии с правилом фаз равновесие системы, состоящей из двух фаз (при двух компонентах), определяется двумя независимыми переменными С=К+2-Ф=2.
Независимые переменные (температура и давление) однозначно определяют зависимую величину- равновесную концентрацию монооксида углерода (см. рисунок 1) в газовой фазе, т.е. % СО=f(T,p).
Температурная зависимость константы равновесия реакции газификации углерода в сравнительно небольшом температурном интервале выражается уравнением:
lg КР=-А/Т+В. (4)
По константам равновесия при различных температурах можно определить стандартное изменение энергии Гиббса DGºT:
DGºT=-RT ln КР=DНº-TDSº, (5)
Взаимодействие углерода с диоксидом СО2 слагается из нескольких стадий и в зависимости от лимитирующего звена может протекать в кинетическом, диффузионном или диффузионно-кинетическом режимах. Кинетический режим взаимодействия характерен для сравнительно низких температур, высоких скоростей газового потока и малых размеров частиц углерода. При этом скорость процесса можно выразить простейшим кинетическим уравнением:
v=k·pnСО2 (6)
где k=k0exp(-E/RT)- константа скорости реакции; Е- кажущаяся энергия активации, Дж/моль; pСО2-парциальное давление диоксида углерода; n- порядок реакций.
Порядок этой реакции в зависимости от условий изменяется от 0 до 1. Диффузионный режим взаимодействия характерен для высоких температур, малых скоростей газового потока и значительных размеров частиц углерода. В диффузионно-кинетическом режиме взаимодействия скорость химической реакции сопоставима со скоростью массопереноса. Скорость реакции газификации углерода при высоких температурах зависит как от поверхностного, так и от внутреннего взаимодействия, т.е. от взаимодействия СО2 в объеме пор, трещин и других внутренних дефектов кусочков углерода. Установлено активирующие действие оксидов и солей некоторых металлов на реакцию газификации углерода. Оксиды и карбонаты щелочных и щелочноземельных металлов, а также оксиды железа, никеля и марганца ускоряют процесс газификации углерода.
Задачи исследования.
Изучить термодинамические характеристики реакции газификации углерода: установить температурные зависимости константы равновесия lg КР=f(1/Т), изменения энергии Гиббса DGº=φ(Т) а также равновесного распределения кислорода и углерода.
Методика исследований.
Исследование проводится с помощью программного комплекса HSC-5 финской компании Outokumpu и программного комплекса «Астра-4».
3.1 Методика исследования равновесия по изменению энергии Гиббса (∆Gто)
Термодинамическая вероятность восстановления металлов определялась посредством расчета изменения энергии Гиббса (ΔGTo) по программе, разработанной в ЮКГУ [109]. Расчет ΔGTo проводили в температурном интервале 300-2100К по уравнению:

; (7)
 где
где  - тепловой эффект химической реакции при 298К, представляющий разницу между суммой теплоты образования продуктов и исходных компонентов реакции:
- тепловой эффект химической реакции при 298К, представляющий разницу между суммой теплоты образования продуктов и исходных компонентов реакции:
; (8)
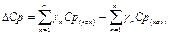
 - изменение теплоемкости системы, представляющие собой разницу между теплоемкостями конечных и исходных реагентов:
- изменение теплоемкости системы, представляющие собой разницу между теплоемкостями конечных и исходных реагентов:
. (9)
Обычно теплоемкость веществ зависит от температуры по следующему уравнению:
 . (10)
. (10)
Для расчета  необходимо
необходимо  выразить посредством уравнения 2 в виде:
выразить посредством уравнения 2 в виде:
 ; (11)
; (11)
где  - разница между суммой коэффициентов “а” конечных веществ и суммой коэффициентов “а” исходных компонентов:
- разница между суммой коэффициентов “а” конечных веществ и суммой коэффициентов “а” исходных компонентов:
 ; (12)
; (12)
 - разница между суммой коэффициентов “b” конечных веществ и суммой коэффициентов “b” исходных компонентов:
- разница между суммой коэффициентов “b” конечных веществ и суммой коэффициентов “b” исходных компонентов:
 ; (13)
; (13)
 - разница между суммой коэффициентов “c” конечных веществ и суммой коэффициентов “c” исходных компонентов:
- разница между суммой коэффициентов “c” конечных веществ и суммой коэффициентов “c” исходных компонентов:
 ; (14)
; (14)
 -энтропия реакции при 298К, подсчитывается как разница стандартных энтропий продуктов и исходных компонентов реакции:
-энтропия реакции при 298К, подсчитывается как разница стандартных энтропий продуктов и исходных компонентов реакции:
 ; (15)
; (15)
 - теплота фазовых переходов (для продуктов) берется со знаком + (плюс), а для исходных — (минус).
- теплота фазовых переходов (для продуктов) берется со знаком + (плюс), а для исходных — (минус).
Количество интегралов в уравнении 1 зависит от количества фазовых переходов от 298 до Т.
При анализе равновесия реакций по ΔGT°, исходили из того, что термодинамическим условием равновесия химической реакции является равенство ΔGT°=0. Если ΔGT°<0, тогда равновесие смещено вправо. При ΔGT°≥0 прямая реакции тернодинамически невероятна. В соответствии с [114] Если ΔGT°≤-30 кДж/моль, тогда оценку термодинамической вероятности реакций можно вести по ΔGT°, т.к. при реальных значениях концентраций реагента величины ΔGT° должны быть меньше нуля. Если ΔGT° > 0 (например, 5-10кДж/моль) это вовсе не означает, что реакция термодинамически невероятна. Она вероятна, но имеет малую степень превращения. Даже при сравнительно больших положительных значениях ΔGT° (например, 30 кДж/моль) реакцию можно сдвинуть вправо, отводя продукт. Такие процессы известны, но они не относятся к равновесным и рассматриваться не будут. Для правильного вывода о степени сдвига равновесия (по величине ΔGT°) необходимо отнести ΔGT° к 1 молю вещества, например, к 1 молю ферросплава, или к 1 атому восстановленного металла, или 1 молю кислорода.





 где
где  - тепловой эффект химической реакции при 298К, представляющий разницу между суммой теплоты образования продуктов и исходных компонентов реакции:
- тепловой эффект химической реакции при 298К, представляющий разницу между суммой теплоты образования продуктов и исходных компонентов реакции: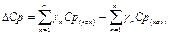
 - изменение теплоемкости системы, представляющие собой разницу между теплоемкостями конечных и исходных реагентов:
- изменение теплоемкости системы, представляющие собой разницу между теплоемкостями конечных и исходных реагентов: . (10)
. (10) необходимо
необходимо  выразить посредством уравнения 2 в виде:
выразить посредством уравнения 2 в виде: ; (11)
; (11) - разница между суммой коэффициентов “а” конечных веществ и суммой коэффициентов “а” исходных компонентов:
- разница между суммой коэффициентов “а” конечных веществ и суммой коэффициентов “а” исходных компонентов: ; (12)
; (12) - разница между суммой коэффициентов “b” конечных веществ и суммой коэффициентов “b” исходных компонентов:
- разница между суммой коэффициентов “b” конечных веществ и суммой коэффициентов “b” исходных компонентов: ; (13)
; (13) - разница между суммой коэффициентов “c” конечных веществ и суммой коэффициентов “c” исходных компонентов:
- разница между суммой коэффициентов “c” конечных веществ и суммой коэффициентов “c” исходных компонентов: ; (14)
; (14) -энтропия реакции при 298К, подсчитывается как разница стандартных энтропий продуктов и исходных компонентов реакции:
-энтропия реакции при 298К, подсчитывается как разница стандартных энтропий продуктов и исходных компонентов реакции: ; (15)
; (15) - теплота фазовых переходов (для продуктов) берется со знаком + (плюс), а для исходных — (минус).
- теплота фазовых переходов (для продуктов) берется со знаком + (плюс), а для исходных — (минус).


