

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
CH4 + OH·®CH3·+H2O
CH3· +O2 + M ®CH3O2·+ M*
CH3O2·+HO2·®CH3OOH + O2
CH3OOH +hn®CH3O· + OH·
CH3O· + O2®CH2=O + HO2·
____________________________________________
CH4 + OH· + CH3· + O2 + hn + M + CH3O2 ·+ HO2· + CH3OOH + CH3O· + O2 ®
CH3· + H2O + CH3O2· + M* + CH3OOH + O2 + CH3O· + OH· + CH2=O + HO2·
______________________
CH4 + O2 + hn® CH2=O + H2O
Образовавшийся формальдегид последовательно взаимодействуя со свободным радикалом гидроксила и озоном превращается в угарный газ и воду, что выражается суммарным уравнением:
CH2=O + O3®СO + H2O + O2
Угарный газ также довольно активно реагирует с озоном, образуя в итоге углекислый газ и кислород:
СO + O3®CO2 + O2
CH4 + O2 + hn + CH2=O + O3 + СO + O3 ®
CH2=O + H2O + СO + H2O + O2 + CO2 + O2
______________________________
Т.о., общий итог окисления СН4 в «чистой» атмосфере:
CH4 + 2 O3 + hn® CO2 + O2 + 2 H2O
В загрязненной NO или СО атмосфере итог реакций окисления иной:
Фотохимия метана в атмосфере, загрязненной оксидами азота и углерода.
CH3O2·+ NO ® NO2 + CH3O·
NO2 + hn ®NO + O
O + O2 + M ® O3 + M*
HO2· + NO ®NO2 + OH·
NO2 + hn ®NO + O
O + O2 + M ® O3 + M*
__________________ + all other reactions
CH4 + 8O2 ®CO2 + 4O3 + 2H2O
Т.о. выброс оксидов азота приводит к накоплению О3 и увеличению окислительного потенциала атмосферы. Это уравнение - итог идеализированной схемы окисления и в полной мере не реализуется вследствие того, что часть промежуточных радикалов и молекул выводится из «атмосферного» реактора в результате турбулентных переносов, вымывания осадками или окисления до муравьиной кислоты в туманах и водной фазе облаков и т.д.
Однако большая часть уравнений выполняется и в низких районах.
Алкены, диены
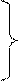 Источники этих соединений в атмосфере:
Источники этих соединений в атмосфере:
§ растительные выделения (особенно изопрен!) фитовыделения
§ фитопланктон;
§ микроорганизмы (микроскопические грибы); (изопрен почти не генерируется таким образом);
|
|
§ природные пожары;
§ антропогенные источники:
-в отработанных газах (в основном этилен и алкены);
-промышленное производство (производство пластмасс, синтетические нагрузки, синтетические волокна)
Атмосферная химия алкенов
Скорость присоединения радикалов и озона значительно увеличивается при увеличении степени замещенности алкильными группами Н при двойной связи.
Основное направление – присоединение гидроксильного радикала НО·.

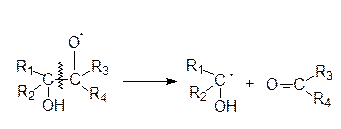

один из главных химических стоков алкенов – взаимодействие с озоном:


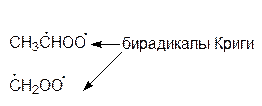
Образовавшиеся бирадикалы (бирадикалы Криги) являются сильными окислителями:
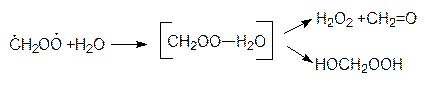
В экспериментах по озонолизу различных алкенов было показано, что образование этих промежуточных продуктов происходит как в газовой, так и в водной фазах.
Неустойчивые пероксиды разлагаются с образованием гидроксильных и алкоксильных радикалов термически, а также под действием солнечной радиации. Таким образом, в результате взаимодействия алкенов с озоном в газовой и капельножидкой фазе образуются множество кислородсодержащих радикалов, что приводит к увеличению окислительного потенциала атмосферы. Особенно это заметно в воздухе городской среды.
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!