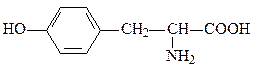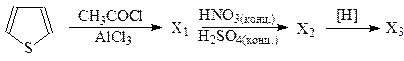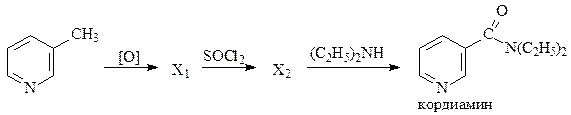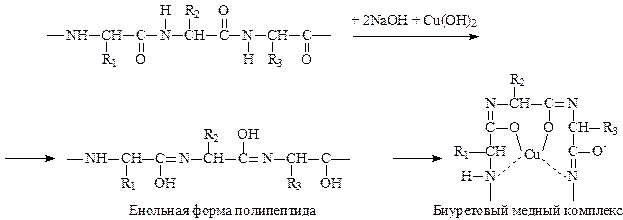Содержание
| | С.
|
| Цели и задачи вариативной части.
|
|
| Место вариативной части в структуре ООП.
|
|
| Требования к результатам освоения вариативной части.
|
|
| Тематический план лекций по вариативной части «Биологически активные вещества и реакции в жизнедеятельности» для студентов 1 курса специальности «Лечебное дело» 1 семестр.
|
|
| Тематический план практических занятий по вариативной части «Биологически активные вещества и реакции в жизнедеятельности» для студентов 1 курса специальности «Лечебное дело» 1 семестр.
|
|
| Общие правила выполнения лабораторных работ.
|
|
| Правила техники безопасности.
|
|
| Первая помощь при несчастных случаях.
|
|
| Занятие №1. Теоретические основы биоорганической химии.
|
|
| Занятие №2. Кислотно-основные свойства органических соединений.
|
|
| Занятие №3. Реакционная способность спиртов, эфиров, фенолов и их тиоаналогов.
|
|
| Занятие №4. Биологически важные реакции карбонильных соединений.
|
|
| Занятие №5. Карбоновые кислоты и их функциональные производные.
|
|
| Занятие №6. Контрольная работа по модулю «Химические основы биологического взаимодействия органических соединений».
|
|
| Занятие №7. Гетерофункциональные соединения.
|
|
| Занятие №8.Пятичленные гетероциклические соединения.
|
|
| Занятие №9. Шестичленные гетероциклические соединения.
|
|
| Занятие №10. α-Аминокислоты. Пептиды. Белки.
|
|
| Занятие №11. Моносахариды.
|
|
| Занятие №12. Ди- и полисахариды.
|
|
| Занятие №13. Контрольная работа по модулю «Низкомолекулярные биоорганические соединения как метаболиты и регуляторы метаболизма».
|
|
| Занятие №14. Нуклеиновые кислоты. Нуклеотидные коферменты.
|
|
| Занятие №15. Омыляемые липиды.
|
|
| Занятие №16. Неомыляемые липиды.
|
|
| Занятие №17. Зачетное занятие.
|
|
| Литература
|
|
Цель и задачи вариативной части
Цели освоения вариативной части:
- формирование системных знаний о закономерностях химического поведения основных биологически важных классов органических соединений и биополимеров во взаимосвязи с их строением для использования этих знаний в качестве основы при изучении процессов, протекающих в живом организме, на молекулярном уровне;
- формирование у студентов умений оперировать химическими формулами органических соединений, выделять в молекулах реакционное центры и определять их потенциальную реакционную способность.
Задачи вариативной части:
- приобретение студентами знаний в области биоорганической химии;
- обучение студентов проведению качественных реакций на функциональные группы и характерные структурные фрагменты молекулы с объяснением визуально наблюдаемого результата;
- обучение студентов прогнозированию направления и результата химических превращений биологически активных веществ in vitro и in vivo;
- подготовка обучающихся к овладению основами дисциплин, изучаемых при подготовке специалистов по направлению Лечебное дело;
- формирование естественнонаучного мировоззрения, пониманию основных закономерностей различных физико-химических, биологических и иных явлений природы и технологических процессов;
- формирование навыков изучения научной литературы и официальных статистических обзоров;
- формирование у студента навыков общения с коллективом.
Место вариативной части в структуре ООП
Вариативная часть биологически активные вещества и реакции в жизнедеятельности относиться к циклу (С2) математических, естественнонаучных и медико-социальных дисциплин.
Требования к результатам освоения вариативной части
Процесс изучения вариативной части направлен на формирование следующих компетенций:
ОК-1– способность к абстрактному мышлению, анализу, синтезу;
ОПК-1 – готовность решать стандартные задачи профессиональной деятельности с использованием информационных, библиографических ресурсов, медико-биологической терминологии, информационно-коммуникационных технологий и учетом основных требований информационной безопасности;
ОПК-7 – готовность к использованию основных физико-химических, математических и иных естественнонаучных понятий, и методов при решении профессиональных задач.
В результате изучения вариативной части студент должен:
Знать:
- цель и задачи биоорганической химии;
- важнейшие реакции свободнорадикального замещения, электрофильного присоединения и замещения, нуклеофильного присоединения и замещения, окисления и восстановления на примерах углеводородов и монофункциональных классов органических соединений;
- кислотно-основные свойства органических соединений;
- специфические свойства гетерофункциональынх органических соединений;
- биологически важные гетероциклические системы;
- структурные компоненты, свойства и структурную организацию молекул углеводов, аминокислот, пептидов, белков;
- строение важнейших представителей низкомолекулярных биорегуляторов (стероидов);
- потенциальную реакционную способность органических соединений;
- роль биологически значимых органических соединений в качестве структурно-функциональных компонентов и молекулярных участников химических процессов, протекающих в живых организмах;
- правила техники безопасности работы в химической лаборатории;
- роль биологически значимых органических соединений в качестве структурно-функциональных компонентов и молекулярных участников химических процессов, протекающих в живых организмах.
Уметь:
- самостоятельно работать с учебной и справочной литературой по биоорганической химии;
- классифицировать органические соединения и называть по структурным формулам типичные представители биологически важных веществ и лекарственных средств;
- выделять функциональные группы, кислотный и основный центры в молекулах для определения потенциальной реакционной способности органических соединений;
- прогнозировать направление и результат химических превращений органических соединений;
- обрабатывать, анализировать и обобщать результаты экспериментальных данных;
- применять полученные знания при изучении биохимии, функциональной биохимии, фармакологии, микробиологии, вирусологии, нормальной физиологии;
- самостоятельно работать с учебной и справочной литературой по биоорганической химии;
- собирать простейшие установки для проведения лабораторных исследований;
- табулировать экспериментальные данные, графически представлять их;
- проводить элементарную статистическую обработку экспериментальных данных в химических экспериментах;
- самостоятельно работать с учебной и справочной литературой по биоорганической химии;
- собирать простейшие установки для проведения лабораторных исследований;
- табулировать экспериментальные данные, графически представлять их;
- проводить элементарную статистическую обработку экспериментальных данных в химических экспериментах.
Владеть:
- проведением качественных реакций на функциональные группы и характерные структурные фрагменты молекулы с объяснением визуально наблюдаемого результата;
- прогнозированием направления и результата химических превращений биологически активных веществ;
- навыками проведения научных исследований для установления взаимосвязи структура-свойство;
- техникой проведения основных химических экспериментов; навыками проведения научных исследований для установления взаимосвязи структура-свойство.
Тематический план лекций и практических занятий по вариативной части
«Биологически активные вещества и реакции в жизнедеятельности»
для студентов 1 курса направления подготовки «Лечебное дело», 1 семестр
| № n/n
| Название тем лекций
| Часы
|
|
| Теоретические основы биоорганической химии
|
|
|
| Биологически важные реакции карбонильных соединений. Карбоновые кислоты и их производные.
|
|
|
| Гетерофункциональные органические соединения. Основные классы и особенности реакционной способности.
|
|
|
| Биологически активные гетероциклические соединения. Нуклеотиды. Нуклеиновые кислоты.
|
|
|
| α-Аминокислоты. Пептиды. Белки.
|
|
|
| Углеводы (моно-, ди- и полисахариды).
|
|
|
| Омыляемые и неомыляемые липиды.
|
|
|
|
| ∑ 14
|
| №
n/n
| Темы практических занятий
| Часы
|
| Модуль 1. «Химические основы биологического взаимодействия органических соединений»
|
|
| Теоретические основы биоорганической химии
|
|
|
| Кислотно-основные свойства органических соединений.
|
|
|
| Реакционная способность спиртов, эфиров, фенолов и их тиоаналогов.
|
|
|
| Биологически важные реакции карбонильных соединений.
|
|
|
| Карбоновые кислоты и их функциональные производные.
|
|
|
| Контрольная работа по модулю «Химические основы биологического взаимодействия органических соединений».
|
|
| Модуль 2. «Низкомолекулярные биоорганические соединения как метаболиты и регуляторы метаболизма»
|
|
| Гетерофункциональные соединения.
|
|
|
| Пятичленные гетероциклические соединения.
|
|
|
| Шестичленные гетероциклические соединения.
|
|
|
| α-Аминокислоты. Пептиды. Белки.
|
|
|
| Моносахариды.
|
|
|
| Ди- и полисахариды.
|
|
|
| Контрольная работа по модулю «Низкомолекулярные биоорганические соединения как метаболиты и регуляторы метаболизма».
|
|
| Модуль 3. Биополимеры и их структурные компоненты. Липиды.
|
|
| Нуклеиновые кислоты. Нуклеотидные коферменты.
|
|
|
| Омыляемые липиды.
|
|
|
| Неомыляемые липиды.
|
|
|
| Зачетное занятие.
|
|
|
|
| ∑ 34
|
Занятие №1
Содержание занятия
Лабораторная работа
Опыт 1. Реакция пинена с KMnO4
В пробирку налейте скипидар, добавьте 1 мл 10% раствора соды, затем по каплям при встряхивании 2% раствор перманганата калия. Фиолетовая окраска исчезает, появляется хлопьевидный осадок бурого цвета.

пинен пиненгликоль
Вопросы и упражнения для аудиторной работы
1. Напишите реакции хлороводорода с пропеном и 2-метилпропеном. Объясните реакционную способность этих соединений в реакциях АЕ.
2. Напишите реакции бромирования циклопропана и циклопентана.
3. Напишите продукты, которые могут быть получены при взаимодействии бутена-1 и бутадиена-1,3 с 1 молем хлороводорода. Объясните причину преобладания продукта 1,4-присоединения для сопряженных диенов.
4. Напишите реакции:
1) гидрирования бутена-1;
2) гидрохлорирования пропина;
3) гидратации пропена, ацетилена и пентина-2.
5. В процессе метаболизма в живых организмах фумаровая кислота (транс -бутендиовая кислота) превращается в яблочную (гидроксибутандиовая кислота). Каким путем можно получить яблочную кислоту из фумаровой в условиях in vitro?
6. На одной из стадий биосинтеза хлортетрациклина в грибах осуществляется хлорирование фенольного фрагмента молекулы. Смоделируйте эту реакцию in vitro на примере хлорирования фенола.
7. Напишите реакции:
1) сульфирования толуола и бензальдегида;
2) нитрования бензосульфокислоты и анилина;
3) алкилирования хлорбензола и бензойной кислоты;
4) ацилирования нитробензола и анилина.
Подведение итогов занятия
7.6 Задание на дом: Кислотно-основные свойства органических соединений.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №2
Содержание занятия
Лабораторная работа
Опыт 1. Образование фенолята натрия и разложение его кислотой
В пробирку поместите несколько капель воды, кристалл фенола и встряхните. К возникшей мутной эмульсии добавьте по каплям 10% раствор гидроксида натрия до образования прозрачного раствора. Напишите уравнение реакции получения фенолята натрия. Добавьте несколько капель соляной кислоты к раствору фенолята натрия. Что при этом наблюдается? Напишите уравнение происходящей реакции.
Вопросы и упражнения для аудиторной работы
1. Расположите в ряд по уменьшению кислотности следующие соединения:
а) этанол, этантиол, этиламин;
б) фенол, п -нитрофенол, п -аминофенол;
в) этанол, пропанол-2, метанол, 2-метилпропанол-2.
Обоснуйте решение, исходя из стабильности анионов.
2. Глицерин взаимодействует с гидроксидом меди (II), а пропанол-1 – нет. Дайте объяснение различию в кислотности и напишите схему реакции.
3. Сравните основность каждой из следующих групп соединений:
а) аммиак, анилин, дифениламин, трифениламин;
б) анилин, п -аминофенол, п -аминобензойная кислота;
4. Чем больше основность простых эфиров, тем легче они расщепляются под действием сильных минеральных кислот. Какое соединение расщепляется легче – диэтиловый эфир или фенилэтиловый эфир (фенетол)?
5. Укажите в молекуле α-аминокислоты тирозине кислотные центры и определите порядок уменьшения их кислотности.
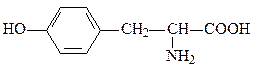
6. В качестве первого антидота при отравлениях соединениями мышьяка был предложен 2,3-димеркаптопропанол. Какие кислотные центры в его молекуле преимущественно участвуют в образовании солей мышьяка?
7. Ощущение сладкого вкуса возникает при одновременном наличии в соединении слабых кислотного и основного центров, находящихся на определенном расстоянии друг от друга и образующих водородные связи с вкусовыми рецепторами. Укажите кислотные и основные центры в молекуле 5-нитро-2-пропоксианилина, который слаще свекловичного сахара в 3100 раз.
Подведение итогов занятия
7.6 Задание на дом: Реакционная способность спиртов, эфиров, фенолов и их тиоаналогов.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №3
Фенолов и их тиоаналогов
1. Актуальность темы. Гидроксипроизводные углеводородов, их тиоаналоги и эфиры находят применение в медицине, фармацевтической практике, входят в состав природных соединений. Метиловый спирт является сильным ядом, в пищеварительном тракте образует формальдегид и муравьиную кислоту. Этиловый спирт действует опьяняюще, а в больших дозах вызывает состояние, близкое к наркозу. Фенолы в организме образуются в результате метаболизма аминокислот, содержащих ароматическое ядро; введение в ароматическое кольцо гидроксильной группы приводит к появлению антисептических свойств. Диэтиловый эфир используется для ингаляционного наркоза, приготовления настоек и экстрактов. Самым распространенным представителем тиолов в организме является кофермент А, который играет важную роль в процессах обмена веществ.
2. Учебные цели. Сформировать знания и умения прогнозировать реакционную способность спиртов, фенолов, простых эфиров и их тиоаналогов в конкурентных реакциях нуклеофильного замещения и элиминирования.
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки
1. Номенклатура спиртов, фенолов, эфиров и их тиоаналогов.
2. Классификация спиртов и фенолов.
3. Химические свойства одно-, двух- и трехатомных спиртов: образование алкоголятов, сложных эфиров; внутри- и межмолекулярная дегидратации; замещение на галоген; окисление.
4. Химические свойства фенолов: реакции по гидроксильной группе; реакции по ароматическому кольцу фенолов.
5. Реакционная способность простых эфиров: образование оксониевых солей, расщепление эфирной связи.
6. Реакционная способность тиоаналогов спиртов и простых эфиров – тиоспиртов и тиоэфиров: образование тиолятов, сульфониевых солей, дисульфидов.
4. Вид занятия: практическое занятие.
5. Продолжительность занятия: 2 академических часа.
6. Оснащение рабочего места:
6.1Посуда и приборы:
| Штатив с пробирками, пипетки, спиртовка, спички, держатель для пробирок.
| на группу
|
6.2. Объекты исследования:
| Глицерин, 1% раствор фенола, этанол.
| на группу
|
6.3. Реактивы:
| 3% Раствор CuSO4, 10% раствор NaOH, 3% раствор FeCl3, 10% раствор Н2SO4, 10% раствор K2Cr2O7.
| на группу
|
Содержание занятия
Лабораторная работа
Опыт 2. Реакция на фенолы
В пробирку с 1-2 мл 1% раствора фенола добавьте 1-2 капли 3% раствора хлорида железа (III). Появляется характерное фиолетовое окрашивание фенолята железа. Напишите схему реакции.
Вопросы и упражнения для аудиторной работы
1. Метиловый спирт при попадании в организм вызывает тяжелое отравление, сопровождающееся потерей зрения. Полагают, что потеря зрения вызвана взаимодействием продукта окисления метанола с белками сетчатки глаза. Напишите схему реакции окисления метанола.
2. Напишите уравнение межмолекулярной дегидратации этанола и
внутримолекулярной дегидратации 2,3-диметилпентанола-3.
3. Какой продукт образуется при дегидратации ментола (2-изопропил-5-метилциклогексанола) в присутствии серной кислоты?
4. Для бутанола-2 напишите реакции получения:
а) алкоголята;
б) сложного эфира;
в) замещения на галоген;
г) окисления.
5. Для фенола напишите следующие реакции:
а) получение фенолята;
б) ацилирование;
в) обработка бромной водой.
6. Напишите уравнения реакции диэтилового эфира с концентрированной серной кислотой; с концентрированной бромоводородной кислотой при нагревании.
7. Напишите реакции:
а) этантиола с гидроксидом натрия;
б) окисления метантиола.
Подведение итогов занятия
7.6 Задание на дом: Биологически важные реакции карбонильных соединений
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №4
Содержание занятия
Лабораторная работа
Вопросы и упражнения для аудиторной работы
1. Напишите уравнения реакций взаимодействия этаналя с 1 и с 2 молями этанола. Какое из соединений выступает в роли нуклеофила?
2. Напишите реакции взаимодействия бензальдегида и ацетальдегида с синильной кислотой. Сопоставьте реакционную способность этих альдегидов.
3. Напишите реакцию альдольной конденсации бутаналя. Какая среда необходима для протекания этой реакции?
4. Напишите реакцию кротоновой конденсации 3-метилбутаналя.
5. Напишите реакцию взаимодействия ацетальдегида с аммиаком и этиламином, объясните ее механизм.
6. Напишите реакцию восстановления уксусного альдегида с использованием алюмогидрида лития.
7. Реакция Канниццаро для формальдегида и бензальдегида. Чем объясняется кислая реакция водного раствора формальдегида?
8. Напишите схемы реакций взаимодействия ацетона со следующими реагентами:
а) гидроксиламином (NH2OH);
б) гидразином (NH2NH2).
9. Напишите реакции окисления альдегидов гидроксидом диамминсеребра и гидроксидом меди (II).
10. Получите 3-метилпентаналь окислением соответствующего спирта.
Подведение итогов занятия
7.6 Задание на дом: Карбоновые кислоты и их функциональные производные.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №5
Содержание занятия
Лабораторная работа
Опыт 2. Открытие щавелевой кислоты в виде кальциевой соли
Щавелевая кислота в виде кальциевой соли содержится в зеленых растениях, а также является компонентом почечных камней (оксалатные камни).
В пробирку поместите лопаточку щавелевой кислоты и прибавьте 4 – 5 капель воды до полного растворения. Пипеткой возьмите 1 каплю раствора и нанесите на предметное стекло. Добавьте к ней 1 каплю раствора хлорида кальция. Выпадает кристаллический осадок.
С кристаллами оксалата кальция можно встретиться при клиническом исследовании мочи. Они имеют форму почтовых конвертов и хорошо видны под микроскопом.
HOOC–COOH + CaCl2 → Ca(COO)2↓ + 2HCl
Вопросы и упражнения для аудиторной работы
1. Напишите уравнение реакции этерификации, приводящей к получению бутилпропионата. Какой катализатор используется в этой реакции?
2. Метилсалицилат относится к группе ненаркотических анальгетиков. Напишите уравнение реакции получения метилсалицилата, использую реакцию этерификации.
3. Напишите реакцию щелочного гидролиза фенилсалицилата (салола), применяющегося в медицине внутрь при кишечных инфекциях.
4. Приведите уравнения реакций получения следующих функциональных производных пропионовой кислоты:
а) амидов;
б) галогенангидридов;
в) нитрилов;
г) ангидридов;
д) солей;
е) гидразидов.
5. Установите строение соединения, если известно, что при его гидролизе образуются валериановая кислота и соль метиламмония. В какой среде протекала реакция гидролиза?
6. Напишите реакции взаимодействия уксусной, пропионовой и акриловой кислот с хлором. Назовите полученные продукты.
7. Напишите реакции, происходящие при нагревании первых четырех членов гомологического ряда двухосновных кислот.
8. Назовите кислоты, которые получаются при окислении:
а) изопропилового спирта; б) 3-метилпентаналя; в) гексанона-2.
9. Напишите реакции образования кислого и среднего эфира из янтарной кислоты и этилового спирта.
10. Расположите в порядке увеличения кислотности следующие кислоты: оксалат (щавелевая кислота), ацетат (уксусная кислота), монохлорацетат (монохлоруксусная кислота).
Подведение итогов занятия
7.6 Задание на дом: Подготовка к контрольной работе по модулю «Химические основы биологического взаимодействия органических соединений»
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №6
Содержание занятия
Образец билета
1. Промежуточные частицы − свободные радикалы, карбокатионы и карбоанионы, их электронное строение и факторы стабильности.
Напишите реакции. Назовите продукты реакций и укажите механизм, по которому они протекают.
а) гидрирование бутена-1;
б) гидрохлорирования пропина;
в) галогенирование 2-метилбутадиена-1,3.
г) сульфирования толуола;
д) ацилирования бензальдегида;
е) нитрования бензосульфокислоты.
В пунктах г) - е) покажите ориентирующее действие заместителей.
2. Химические свойства одно-, двух- и трехатомных спиртов (на примере пропанола-1 и этиленгликоля): образование алкоголятов, сложных эфиров; внутри- и межмолекулярная дегидратации; замещение на галоген; окисление.
3. Электронная теория кислот и оснований (теория Льюиса).
Расположите в ряд по уменьшению кислотности следующие соединения: фенол, п -нитрофенол, п -аминофенол. Обоснуйте свой ответ, основываясь на стабильности соответствующих анионов.
4. Химические свойства альдегидов и кетонов (на примере бутаналя и ацетона): присоединение спиртов, тиолов, воды, циановодородной кислоты, аминов, гидразинов и их производных.
К какому классу относятся продукты реакций?
5. Свойства дикарбоновых кислот (щавелевая, малоновая, янтарная, глутаровая кислоты):
а) повышенная кислотность первых гомологов;
б) склонность к декарбоксилированию;
в) циклизация.
7.6 Задание на дом: Гетерофункциональные соединения.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №7
Содержание занятия
Лабораторная работа
Вопросы и упражнения для аудиторной работы
1. Напишите по две реакции для каждой функциональной группы гликолевой кислоты.
2. Напишите реакции пировиноградной кислоты с:
а) гидроксиламином;
б) этанолом;
в) тионилхлоридом;
г) циановодородной кислотой.
3. Напишите специфические реакции, происходящие при нагревании молочной кислоты (без и в присутствии минеральной кислоты).
4. Напишите специфические реакции, происходящие при нагревании α-аминопропановой, β-гидроксимасляной, γ-гидроксиимасляной кислот. Назовите полученные продукты.
5. Напишите схему расщепления лимонной кислоты при нагревании ее с серной кислотой. Назовите конечные продукты.
6. Покажите явление кето-енольной таутомерии на примере ацетоуксусного эфира и напишите уравнения реакций, доказывающих наличие кетонной и енольной форм.
7. Напишите реакции восстановления и декарбоксилирования ацетоуксусной кислоты. При каком заболевании проводится определение в моче продукта декарбоксилирования?
8. В качестве анальгетиков и противовоспалительных средств используются производные салициловой кислоты – метилсалицилат и ацетилсалициловая кислота. При участии каких функциональных групп салициловой кислоты получаются эти производные?
9. Приведите формулы эфиров п -аминобензойной кислоты (анестезина и новокаина) и общую структуру сульфаниламидных препаратов.
10. Приведите формулы производных угольной кислоты, имеющих значение в медицине.
Подведение итогов занятия
7.6 Задание на дом: Пятичленные гетероциклические соединения.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие №8
Содержание занятия
Лабораторная работа
Опыт 1. Реакция образования фурфурола
В пробирку поместите небольшое количество (высотой 15-20 мм) опилок, смочите их приготовленной отдельно смесью концентрированной соляной кислоты и воды (в соотношении 1:1), перемешайте и прокипятите. Смочите узкую полоску фильтровальной бумаги смесью из 2 капель анилина и 4 капель 2 н. уксусной кислоты и опустите в пробирку с кипящей смесью. В парах смеси фильтровальная бумага окрашивается в розово-красный цвет продукта конденсации фурфурола с анилином.
Вопросы и упражнения для аудиторной работы
1. Напишите схемы реакций нитрования тиофена и пиррола. Какой их этих гетероциклов проявляет ацидофобность и каким образом это учитывается при выборе нитрующего агента?
2. Напишите схему реакции ацилирования и сульфирования тиофена. Объясните, почему реакцию сульфирования тиофена используют для удаления из бензола примеси тиофена?
3. Приведите реакцию получения тетрагидрофурана из фурана.
4. Напишите реакцию взаимодействия пиррола с амидом натрия. Какие свойства проявляет пиррол в этой реакции?
5. На первой стадии синтеза противомикробных средств фуранового ряда проводится реакция нитрования фурфурола (фуран-2-карбальдегида). Почему фурфурол в отличие от фурана можно нитровать азотной кислотой? Напишите уравнение реакции.
6. Индол и его биологически активные производные: триптамин, триптофан, серотонин.
7. Объясните, почему имидазол в отличие от пиррола проявляет более сильные кислотные свойства. Напишите схему реакции, доказывающей кислотные свойства имидазола.
8. Гистамин является одним из эндогенных факторов (медиаторов), участвующих в регуляции жизненно важных функций организма и играющих важную роль в патогенезе ряда болезненных состояний; образуется в организме при декарбоксилировании аминокислоты гистидина. Приведите синтез гистамина из гистидина.
9. Осуществите превращения:
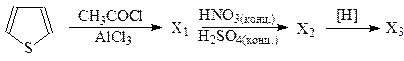
Подведение итогов занятия
7.6 Задание на дом: Шестичленные гетероциклические соединения.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [4].
Занятие №9
Содержание занятия
Лабораторная работа
Опыт 1. Свойства пиридина
Пиридиновое ядро является основой многих алкалоидов (никотина, анабазина и др.), витаминов (никотиновой кислоты, витаминов группы В6), а также лекарственных средств.
В пробирку поместите 2 капли пиридина и около 2 мл воды. Отметьте растворимость пиридина в воде и его специфический запах. Раствор используйте для проведения опытов А-Б.

А. С помощью стеклянной палочки поместите по 1 капле полученного раствора пиридина на полоску красной лакмусовой и универсальной индикаторной бумаги. Отметьте изменение окраски индикаторов.
Б. В пробирку поместите 5 капель раствора пиридина и добавьте 5 капель 1% раствора хлорида железа (III). Отметьте цвет выпавшего осадка.

Вопросы и упражнения для аудиторной работы
1. Напишите схемы реакций взаимодействия пиридина с:
а) с соляной и серной кислотами на холоду;
б) йодистым этилом;
в) амидом натрия;
г) нитрующей смесью;
д) избытком водорода.
2. Объясните причины уменьшения основных свойств в ряду имидазол, пиридин, пиримидин. Напишите схемы реакций, доказывающих основные свойства этих соединений.
3. Кордиамин (стимулятор центральной нервной системы) представляет собой 25% водный раствор N,N-диэтиламида никотиновоый кислоты. Напишите схему синтеза кордиамина согласно следующей схеме:
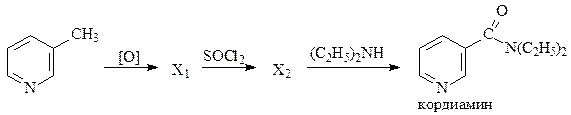
4. Никотиновая кислота - витамин, участвующий во многих окислительных реакциях живых клеток. Она может быть синтезирована окислением хинолина до пиридин-2,3-дикарбоновой кислоты с последующим ее декарбокслированием. Напишите схему синтеза никотиновой кислоты.
5. Какой тип таутомерии характерен для тимина и урацила? Напишите схему таутомерных превращений тимина и урацила. Укажите, какая таутомерная форма преобладает в смеси таутомеров.
6. Напишите схемы реакций взаимодействия хинолина с:
а) с соляной и серной кислотами на холоду;
б) йодистым этилом;
в) амидом натрия;
г) нитрующей смесью.
Назовите продукты реакции.
7. Химическая основа действия кофермента НАД+. Приведите реакцию алкилпиридиниевого иона с гидрид-ионом.
8. Осуществите превращения:
1)

2)

Подведение итогов занятия
7.6 Задание на дом: α-аминокислоты. Пептиды. Белки.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [4].
Занятие №10
α-Аминокислоты. Пептиды. Белки
1. Актуальность темы. Белки как основа всего живого были издавна в центре внимания естественных наук. Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Пептиды имеют меньшую молекулярную массу, чем белки. В биологическом плане пептиды отличаются от белков более узким спектром функций. Многообразные пептиды и белки состоят из остатков α-аминокислот. Общее число встречающихся аминокислот в природе достигает 100, однако некоторые из них обнаружены лишь в определенном обществе организмов или даже в одном из видов. Известно 20 наиболее важных α-аминокислот, постоянно встречающихся во всех белках.
2. Учебные цели. Сформировать знания о строении и свойствах важнейших α-аминокислот, о структурной организации пептидов и белков.
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки
1. α-Аминокислоты, входящие в состав белков. Строение. Номенклатура.
2. Классификация α-аминокислот по химической природе радикала и содержащихся в нем заместителей; по кислотно-основным свойствам.
3. Химические свойства α-аминокислот по карбоксильной и аминогруппам. Специфические свойства α-аминокислот: отношение к нагреванию, комплексообразование. Качественные реакции.
4. Реакции трансаминирования и восстановительного аминирования. Реакции дезаминирования, декарбоксилирования, окисления тиольных групп.
5. Первичная структура пептидов и белков. Методы определения N- и С-концевых аминокислот. Образование ФТГ-производных (реакция Эдмана).
6. Частичный и полный гидролиз белков.
4. Вид занятия: практическое занятие.
5. Продолжительность занятия: 2 академических часа.
6. Оснащение рабочего места:
6.1Посуда и приборы:
| Штатив с пробирками, пипетки.
| на группу
|
6.2. Объекты исследования:
| 1% Раствор глицина, раствор яичного белка, раствор желатина.
| на группу
|
6.3. Реактивы:
| Метиловый красный, формалин, 5% раствор NaNO2, CН3СООН(конц.), 10% раствор NaOH, 2% раствор CuSO4.
| на группу
|
Содержание занятия
Лабораторная работа
Опыт 3. Биуретовая реакция
Биуретовая реакция позволяет обнаружить структурный фрагмент, содержащий не менее двух амидных групп. Реакция основана на способности пептидной группы белков и полипептидов образовывать с ионами меди в щелочной среде комплексные соединения фиолетового цвета.
Реакция позволяет обнаружить наличие пептидной группы –СONH- в исследуемом веществе и, следовательно, является универсальной реакцией для обнаружения веществ белковой природы. Свое название реакция получила от производного мочевины биурета, который дает в данных условиях то же окрашивание, что и белок. Окрашивание появляется за счет образования медной комплексной соли следующего строения:
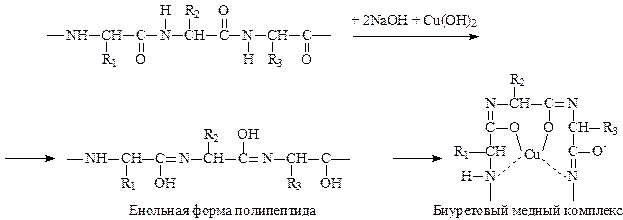
В одну пробирку поместите 5 капель раствора яичного белка, в другую – раствор желатина. В обе пробирки добавьте по 10 капель раствора едкого натра и по 1 капле раствора сульфата меди. В той и другой пробирке появляется красно-фиолетовое или сине-фиолетовое окрашивание.
Вопросы и упражнения для аудиторной работы
1. На примере реакции N-ацилирования валина объясните, почему эта реакция может использоваться для защиты аминогруппы. Напишите схему реакции.
2. Образование оснований Шиффа часто происходит в процессах превращений α-аминокислот в организме. Напишите схему реакции взаимодействия аланина с уксусным альдегидом. Какое соединение образуется при взаимодействии алани