Элементарными (одностадийными) называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое. Механизм такой реакции соответствует ее стехиометрическому уравнению. Кинетическое уравнение необратимой элементарной реакции
 А А +
А А + 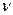 В В
В В 
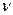 С С +
С С + 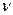 Р Р
Р Р
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид
Wi = k C  С
С  ∙ … ∙С
∙ … ∙С 

 (3.9)
(3.9)
где k- константа скорости реакции; 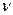 А,
А, 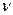 В,
В, 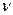 I – частный порядок реакции по i компоненту; СА, СВ, Сi – концентрации i -го вещества.
I – частный порядок реакции по i компоненту; СА, СВ, Сi – концентрации i -го вещества.
Под термином «частный порядок реакции» понимают показатель степени, в которой концентрация i -го вещества входит в кинетическое уравнение. Сумма частных порядков составляет общий порядок реакции 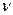 , определяющий вид кинетического уравнения и размерность константы скорости:
, определяющий вид кинетического уравнения и размерность константы скорости:
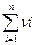 =
= 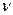 (3.10)
(3.10)
Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции.
Наряду с понятием «порядок реакции» в химической кинетике используют понятие «молекулярность». Молекулярность реакции равна минимальному числу молекул, одновременно принимающих участие в одном элементарном акте реакции.
Для элементарных реакций порядок равен молекулярности и может иметь значения 1, 2, 3. Порядок (или молекулярность) элементарных реакций не превышает значения 3, так как вероятность одновременного столкновения более чем трех молекул чрезвычайно низка. Большинство элементарных реакций – это реакции второго порядка.
Сопоставив уравнения (3.2) и (3.9) получаем дифференциальное уравнение скорости
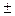
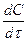 i = k C
i = k C  С
С  ∙ … ∙С
∙ … ∙С  .
. 
 (3.11)
(3.11)
Скорость реакции можно определить по каждому из компонентов; знак ее зависит от знака стехиометрического коэффициента этого компонента ( I).
I).
В общем виде
W = Wi / 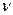 i, (3.12)
i, (3.12)
где 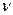 I – стехиометрический коэффициент i –го компонента.
I – стехиометрический коэффициент i –го компонента.
Скорость реакции, как правило, определяется по одному из компонентов, наиболее легко определяемому при проведении эксперимента.
Уравнение (3.12) действительно для простых (элементарных) реакций.
Из кинетических уравнений следует, что скорость простой реакции пропорциональна концентрациям веществ, являющихся реагентами в данной реакции. Следовательно, для простых реакций увеличение концентрации исходных веществ практически всегда приводит к увеличению скорости (за исключением реакций нулевого порядка, скорость которых не зависит от концентрации).
Если приведенная выше реакция характеризуется различающимися частными порядками по компонентам А и В, то наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок. Например, если кинетическое уравнение реакции, в котором участвуют два реагента, имеет вид
W = k C 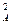 C
C  ,
,
то увеличение концентрации реагента А в два раза вызовет рост скорости в четыре раза (22), а двукратное увеличения концентрации реагента В приведет к увеличению скорости лишь в 1,4 раза ( ).
).
Кинетика сложных реакций
Большинство химических реакций протекает через ряд промежуточных стадий. Стехиометрическое уравнение неэлементарной (сложной) реакции отражает лишь начальное и конечное состояния данной реакционной системы и не описывает механизм реакции.
Сложную реакцию иногда удобно рассматривать как формально простую, т.е. считать, что она протекает в одну, а не в несколько стадий. Так можно поступить, если в условиях рассматриваемой задачи промежуточные продукты не обнаруживаются.
Для формально простой реакции кинетическое уравнение по аналогии с простой (элементарной) реакцией можно записать в следующем виде:
− 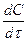 А = k C
А = k C 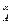 С
С 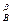 , (3.13)
, (3.13)
где 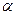 и
и 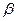 - частные порядки реакции (находят экспериментально).
- частные порядки реакции (находят экспериментально).
В общем случае 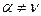 А и
А и 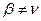 В, т.е. молекулярность и порядок реакции не совпадают. Полный порядок реакции
В, т.е. молекулярность и порядок реакции не совпадают. Полный порядок реакции 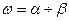 и частные порядки в таком уравнении могут быть целыми числами, но могут быть и дробными, так как закон равновесных концентраций, предполагающий показатели степеней в виде целых чисел в кинетическом уравнении, строго применим только к элементарным реакциям.
и частные порядки в таком уравнении могут быть целыми числами, но могут быть и дробными, так как закон равновесных концентраций, предполагающий показатели степеней в виде целых чисел в кинетическом уравнении, строго применим только к элементарным реакциям.
Наряду с неэлементарными реакциями, которые можно рассматривать как формально простые, существует много сложных реакций, которые явно распадаются на стадии и продукты различных стадий которых образуются в значительных количествах.
Простейшими типами сложных реакций являются параллельные и последовательные.
В параллельных реакциях взаимодействие одних и тех же реагентов может протекать по различным реакционным путям с образованием различных продуктов. В качестве примера можно назвать параллельные реакции окисления аммиака, продуктами которых могут быть или NO, или N2O, или N2.
В последовательных реакциях продукт первой реакции является исходным реагентам для второй; реакция может состоять как из двух, так и из большего числа стадий, следующих одна за другой. Примером таких реакций могут служить реакции расщепления углеводородов с длинной углеродной цепочкой на все более мелкие молекулы.
Если известен механизм сложной реакции (элементарные стадии, через которые она протекает), скорость реакции по одному из веществ ее участников равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество принимает участие.
При определении знаков слагаемых этой суммы удобно пользоваться формальным правилом: производной концентрации данного компонента по времени dCi / d  приписывают знак «минус» независимо от того, является компонент i исходным реагентом или продуктом реакции; скорости элементарных стадий, в которых компонент i расходуется (является реагентом), записывают в общей сумме со знаком «плюс»; скорости стадий, в которых компонент i образуется (является продуктом), - со знаком «минус».
приписывают знак «минус» независимо от того, является компонент i исходным реагентом или продуктом реакции; скорости элементарных стадий, в которых компонент i расходуется (является реагентом), записывают в общей сумме со знаком «плюс»; скорости стадий, в которых компонент i образуется (является продуктом), - со знаком «минус».
Тогда общая скорость превращения i –го вещества будет связана со скоростью соответствующих реакций уравнением
Wi = 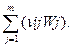 (3.14)
(3.14)
Скорость каждой простой реакции является функцией концентраций веществ, участвующих в этой реакции, и некоторых постоянных: kj – константы скорости; Ка – константы равновесия; Еj – энергии активации, которые называются параметрами химической реакции 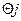 . На реакциювлияют также внешние факторы(Сi, Рi, Т), которые называются параметрами химического процесса, определяющими условия его проведения. Тогда
. На реакциювлияют также внешние факторы(Сi, Рi, Т), которые называются параметрами химического процесса, определяющими условия его проведения. Тогда
Wi = f (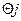 ,Сi, Т). (3.15)
,Сi, Т). (3.15)
Совокупность таких уравнений для всех ключевых веществ называется кинетической моделью реакции. Задача кинетических исследований – найти параметры химической реакции и химического процесса для построения кинетической модели.
Для сложных реакций вопрос о выборе концентраций реагентов для управления процессом не является однозначным. Рассмотрим для примера систему из двух параллельных реакций разного порядка при постоянной температуре.
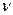 А1 А
А1 А 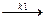 С С
С С
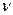 А2 А
А2 А 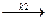 D D
D D
Говоря об увеличении скорости такой реакции, нужно сначала решить, какая реакция более важна, т.е. какая реакция приводит к образованию целевого продукта. Нас интересует не то, как быстро израсходуется реагент А, а насколько быстрее целевой продукт будет образовываться по сравнению с побочным продуктом.
Пусть в рассматриваемом примере целевым является продукт первой реакции С, побочным – продукт D.
Для анализа соотношений скоростей целевого и побочных продуктов пользуются мгновенной, или дифференциальной, селективностью, равной отношению скорости расходования реагента А на целевую реакцию к общей скорости расходования реагента и на целевую, и на побочные реакции:
S 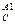 = W A
= W A  C / WA. (3.16)
C / WA. (3.16)
Значение дифференциальной селективности в ходе процесса в общем случае не остается постоянным, так как оно определяется соотношением скоростей реакции, а они по мере ее протекания меняются.
Лишь в том случае, когда параметры процесса во времени и в пространстве не меняются, S 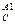 остается постоянной величиной.
остается постоянной величиной.
Если порядок целевой реакции по исходному реагенту больше порядка побочной реакции, то скорость целевой реакции с ростом концентрации исходного реагента возрастет значительно быстрее скорости побочной реакции и доля скорости целевой реакции в суммарной скорости увеличится.
В этом случае желаемый результат – увеличение скорости образования целевого продукта В по сравнению со скоростью образования побочного продукта С (увеличение дифференциальной селективности) достигается при использовании высокой концентрации исходного реагента.
В случае, когда порядок целевой реакции по исходному реагенту меньше порядка побочной реакции, зависимость S 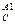 от концентрации исходногореагента обратная, и более высокая дифференциальная селективность по целевому продукту достигается при низкой концентрации исходного реагента. Следовательно, не всегда выгодно стремиться увеличивать концентрацию реагента. Правда, при низкой концентрации реагента небольшой будет скорость при прочих равных условиях. Тогда нужно искать другие пути увеличения скорости реакции при сохранении высокодифференциальной селективности. При равенстве порядков целевой и побочной реакций дифференциальная скорость остается постоянной величиной для любых концентраций исходных реагентов, и изменить S
от концентрации исходногореагента обратная, и более высокая дифференциальная селективность по целевому продукту достигается при низкой концентрации исходного реагента. Следовательно, не всегда выгодно стремиться увеличивать концентрацию реагента. Правда, при низкой концентрации реагента небольшой будет скорость при прочих равных условиях. Тогда нужно искать другие пути увеличения скорости реакции при сохранении высокодифференциальной селективности. При равенстве порядков целевой и побочной реакций дифференциальная скорость остается постоянной величиной для любых концентраций исходных реагентов, и изменить S 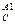 можно, лишь изменив соотношение k2 / k1.
можно, лишь изменив соотношение k2 / k1.



 А А +
А А + 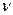 В В
В В 
 С
С  ∙ … ∙С
∙ … ∙С 

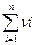 =
= 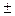
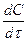 i = k C
i = k C  I).
I).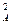 C
C  ,
, ).
).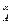 С
С 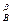 , (3.13)
, (3.13)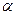 и
и 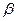 - частные порядки реакции (находят экспериментально).
- частные порядки реакции (находят экспериментально).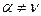 А и
А и 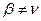 В, т.е. молекулярность и порядок реакции не совпадают. Полный порядок реакции
В, т.е. молекулярность и порядок реакции не совпадают. Полный порядок реакции 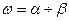 и частные порядки в таком уравнении могут быть целыми числами, но могут быть и дробными, так как закон равновесных концентраций, предполагающий показатели степеней в виде целых чисел в кинетическом уравнении, строго применим только к элементарным реакциям.
и частные порядки в таком уравнении могут быть целыми числами, но могут быть и дробными, так как закон равновесных концентраций, предполагающий показатели степеней в виде целых чисел в кинетическом уравнении, строго применим только к элементарным реакциям. приписывают знак «минус» независимо от того, является компонент i исходным реагентом или продуктом реакции; скорости элементарных стадий, в которых компонент i расходуется (является реагентом), записывают в общей сумме со знаком «плюс»; скорости стадий, в которых компонент i образуется (является продуктом), - со знаком «минус».
приписывают знак «минус» независимо от того, является компонент i исходным реагентом или продуктом реакции; скорости элементарных стадий, в которых компонент i расходуется (является реагентом), записывают в общей сумме со знаком «плюс»; скорости стадий, в которых компонент i образуется (является продуктом), - со знаком «минус».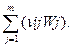 (3.14)
(3.14)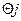 . На реакциювлияют также внешние факторы(Сi, Рi, Т), которые называются параметрами химического процесса, определяющими условия его проведения. Тогда
. На реакциювлияют также внешние факторы(Сi, Рi, Т), которые называются параметрами химического процесса, определяющими условия его проведения. Тогда С С
С С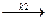 D D
D D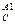 = W A
= W A 


