К молекулярным коллоидам относятся природные и синтетические высокомолекулярные вещества с молекулярным весом от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц. Из-за огромного размера такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений – это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов.
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем.
Неполярные макромолекулы растворяются в углеводородах (например, каучуки в бензоле), а полярные макромолекулы в полярных растворителях (например, некоторые белки - в воде и водных растворах солей).
Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор.
Растворение макромолекулярных коллоидов проходит через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа.
При набухании молекулы растворителя проникают в твёрдый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличеннии объёма полимера.
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и, часто, понижение температуры приводят к застудневанию, т.е. к превращению сильно вязкого, но всё же текучего раствора, в сохраняющий форму твёрдообразный студень.
Растворы полимеров с сильно вытянутыми макромолекулами застудневают при небольшой концентрации раствора. Так, желатин и агар-агар образуют студни и гели в
0,2-1% растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей).
Строение коллоидной мицеллы
Строение коллоидных частиц удобнее рассматривать, если проследить процессы их образования. Сделаем это на примере частиц AgI.
Образование коллоидной частицы AgI происходит в результате реакции:
AgNO3 + KI → AgI↓ + KNO3.
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионы Ag+ и I- образуют кристаллическую решётку.
Новообразованные частицы сначала имеют аморфное строение, затем в них постепенно происходит кристаллизация.
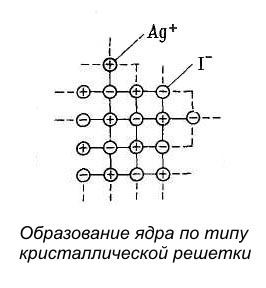
Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. Так, при избытке AgNO3 в растворе будет находится большое количество ионов Ag+ и NO3-. Однако построение кристаллической решетки AgI согласно правилу Панета – Фаянса может идти только за счёт ионов, входящих в её состав; в данном случае за счёт ионов Ag+.
Ионы Ag+ будут продолжать достраивать кристаллическую решётку ядра, прочно входя в её структуру и сообщая ему электрический потенциал.

1 - электронейтральное ядро
2 - зона достройки ядра потенциалопределяющими ионами
3 - адсорбционный слой
4 - противоионы адсорбционного слоя
В связи с этим ионы, достроившие кристаллическую решётку ядра, называются потенциалопределяющими ионами.
Величина электродинамического потенциала, или Е -потенциала, у многих коллоидных частиц достигает 1 В. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3 (называемые поэтому противоионами). Начнётся процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами.
Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой (позиция 3 на рисунке выше).
Ядро и адсорбционный слой вместе составляют гранулу. Гранула имеет электрический потенциал того же знака, что и Е -потенциал, но величина его меньше и зависит от количества противоионов в адсорбционном слое.
Так, если 90% их адсорбировано, то и потенциал гранулы составит 10% от
Е -потенциала.
Потенциал гранулы называется электрокинетическим или дзета-потенциалом
(ζ -потенциал). Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц в электрическом поле. Его можно определить также, как потенциал на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями. (о диффузном слое см. ниже)
Остаток противоионов удерживается электростатическими силами притяжения вблизизи гранулы, образуя диффузный слой (позиция 5 на рисунке ниже).
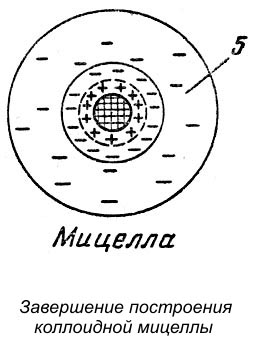
5 - диффузный слой, состоящий из противоионов, не вошедших в адсорбционный слой гранулы
Гранула вместе с диффузным слоем образует мицеллу.
Толщина диффузного слоя различна, так как зависит от ионной силы раствора: чем ионная сила выше, тем толщина слоя меньше.
Концентрация противоионов в диффузном слое убывает по направлению к переферии. Соответственно этому убывает и потенциал частицы, падая на границе дифузного слоя до нуля. Таким образом, мицелла всегда электронейтральна.
Если переместить в адсорбционный слой большое количество противоионов, например 95%, электрокинетический (ζ-потенциал), измеряемый на поверхности гранулы, уменьшится до 5% от величины Е-потенциала. Величина Е-потенциала, зависящая от потенциал-определяющих ионов меняться не будет.
Устойчивость коллоидных растворов обусловлена присутствием стабилизатора, т.е. электролита и зависит от величины заряда гранулы (ζ-потенциала). Чем выше этот потенциал, тем сильнее оказываются силы взаимного отталкивания частиц, препятствующие их объединению при столкновениях, наблюдающихся в результате броуновского движения.









