образования ковалентной связи
Рассмотренный механизм возникновения ковалентных связей путем обобщения непарных электронов двух атомов, получил название “обменного механизма”. Образование ковалентной связи может происходить также при взаимодействии одного атома или иона с заполненной атомной орбиталью с другим атомом или ионом, имеющим вакантную (свободную) орбиталь. Такой механизм образования ковалентной связи называется донорно-акцепторным. Атом или ион, поставляющий пару электронов, называется донором, а атом или ион, к которому эта пара электронов перемещается – акцептором. Согласно методу ВС ковалентная связь по донорно-акцепторному механизму возникает при перекрывании орбитали одного атома или иона с заполненными орбиталями донора или донорной группы. Поэтому донорная группа должна содержать по меньшей мере одну неподеленную пару электронов. Например, образование молекулы H2 по донорно-акцепторному механизму можно представить следующим образом:
 H- ¯ + H+ → H ¯ H
H- ¯ + H+ → H ¯ H
 1S - AO первого иона-протона H+ свободна, что условно обозначается
1S - AO первого иона-протона H+ свободна, что условно обозначается
У второго иона (гидрид ион H-) имеется два электрона и его электронная конфигурация 1s2. Ядро гидрид - иона окружает двухэлектронное облако с антипараллельными спинами электронов. При сближении ионов двухэлектронное облако гидрид - иона притягивается к протону и в конечном счете становится общим для обеих ядер водорода, т.е. превращается в двухэлектронное молекулярное облако. В данном примере донор – гидрид-ион H-, акцептор – протон H+
В соответствии с двумя механизмами образования ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. Это элементы второго периода и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего уровня: одной 2s и трем 2p:

Поскольку у бора и углерода имеются энергетически близкие свободные 2p орбитали, при возбуждении эти элементы могут приобретать новые электронные конфигурации:

В соответствии с числом непарных электронов атомы B, C и N могут образовывать соответственно 3, 4, 3 ковалентные связи, например с атомами водорода:

В молекуле BH3 дефицит электронов – атом бора имеет свободную орбиталь. В молекуле же NH3 при атоме азота имеется неподеленная, или, как говорят, несвязывающая электронная пара. Таким образом, молекула BH3 может выступать как акцептор электронной пары, а молекула NH3 – как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму. Простей-
ший донор электронной пары – гидрид-ион H-. Присоединение отрицательного гидрид иона к молекуле BH3 приводит к образованию сложного (комплексного) иона BH4- с отрицательным зарядом:

Простейший акцептор электронной пары – протон; его присоединение к молекуле NH3 тоже приводит к образованию комплексного иона NH4+, но уже с положительным зарядом:

В этих соединениях атомы бора и азота четырехвалентны. Таким образом, валентность элемента в общем случае определяется числом орбиталей, использованных при образовании химической связи. У элементов 2-го периода имеются 4 валентных орбитали, поэтому максимально возможное число ковалентных связей равно четырем. У элементов 3-его и последующих периодов роль валентных могут играть также внешние d- орбитали и f- орбитали.
Свойства ковалентной связи
Особенностью ковалентной химической связи является ее насыщаемость, направленность и полярность.
Насыщаемость связи. Из приведенных выше примеров следует, что молекулы существуют в устойчивом состоянии
строго определенного состава H2, CH4, BF3, BH4-, BH3 и т.д., но не H3, CH5 и т.д. Таким образом, при образовании ковалентной связи происходит ее насыщение. Объяснить это можно следующим образом: пара электронов (H2, CH4) образующих связь всегда будут отталкивать неспаренный электрон приближающегося третьего атома, т.к. в электронной паре (H2) представлены обе возможности ориентации спина. Кроме того, насыщаемость ковалентной связи можно объяснить тем, что для образования химической связи необходимо оптимальное накопление электронной плотности между ядрами, а ее избыток или недостаток приводит к повышению полной энергии системы.
Направленность связи. Наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определенную форму, то их максимальное перекрывание возможно при определенной пространственной ориентации. Направленность – важнейшее свойство ковалентной связи, зависящее от типа взаимодействующих электронов и числа атомов. Направленность связи объясняется тем, что электронные облака различной формы имеют определенное пространственное направление. s – облако имеет форму сферы, p – облако – форму гантели, расположенные вдоль трех осей (px py pz).
s, p и d - связи. В зависимости от направления перекрывания атомных орбиталей различают s, p и d - связи.
s - связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов. Простейший случай s - связи наблюдается у молекулы H2, образуется за счет перекрывания s – орбиталей атомов водорода (рис. 10, а); s - связь может возникнуть также при перекрывании s и p – орбиталей (б); двух p – орбиталей (в); двух d – орбиталей (г); d и s – орбиталей; d и p – орбиталей
а б


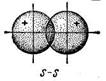

в г
Рис. 10. Схема перекрывания орбиталей
при образовании s - связи
p - связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух p – орбиталей, расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания (рис. 11). Соответственно p - связь характеризуется двумя областями перекрывания, расположенными по обе стороны, соединяющей ядра атомов.

Рис. 11. Схема перекрывания p – орбиталей
при образовании p - связи
Например, рассмотрим строение молекулы N2
Связь осуществляется за счет перекрывания
3 - p – электронных облаков вдоль оси
x, y и
z
Рис. 12. Образование s - связи в молекуле N2
Перекрывание электронных облаков происходит вдоль линии, соединяющей центры атомов, а также перпендикулярно линии, соединяющей центры
Рис. 13. Образование p - связей в молекуле N2
Как видно, в молекуле N2 между атомами азота осуществляется одна s - связь (рис. 12) и две p - связи (рис. 13).
Рис. 14. Схема образования d - связи
d - связь возникает при перекрывании двух d – атомных орбиталей, расположенных в параллельных плоскостях, четырьмя лепестками (рис. 14).
Таким образом, s– электроны могут участвовать лишь в образовании s - связи, p– электроны – в образовании s и p - связей, а d– электроны – как в образовании s и p - связей, так и d - связей.
p - и d - связи налагаются на s - связи, вследствие чего образуются двойные и тройные, как, например, в молекуле азота. Количество связей, образующих между атомами, называется кратностью (порядком) связи. С увеличением кратности связи изменяются длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это вызвано тем, что энергия p - связи меньше, чем энергия s - связей; p - связь менее прочная, чем s - связь и разрушается при химических взаимодействиях в первую очередь.
Гибридизация атомных орбиталей. При образовании нескольких химических связей иногда участвуют различные атомные орбитали одного и того же атома. Например, в молекуле метана четыре химические связи образованы путем перекрывания трех p и одной s – орбитали атома углерода с четырьмя s – орбиталями атомов водорода. Так как энергия и форма s и p – орбиталей различны, то можно было бы ожидать, что одна из четырех связей в молекуле метана будет отличать-
ся от других связей по прочности и по характеру направленно-
сти. Однако эксперименты показали, что все четыре связи в молекуле метана равноценны. Этот и другие подобные факты удалось объяснить при помощи теории гибридизации. Согласно этой теории при образовании молекул происходит изменение формы и энергии атомные орбиталей. Вместо неравноценных, например, s и p – орбиталей образуются равноценные гибридные орбитали, имеющие одинаковую форму и энергию, т.е. происходит гибридизация (смешение) атомных орбиталей. При образовании химических связей с участием гибридных орбиталей выделяется больше энергии, чем при образовании связей с участием отдельных s и p – орбиталей, поэтому гибридизация атомных орбиталей приводит к большему понижению энергии системы и соответственно повышению устойчивости молекулы.

Рис. 15. Форма sp – гибридной орбитали
Гибридная орбиталь по форме отличается от атомных орбиталей. Так, гибридная s и p – орбиталь отличается большей вытянутостью по одну сторону от ядра, чем по другую (рис. 15).
Электронная плотность в области перекрывания гибридного электронного облака будет больше электронной плотности в области перекрывания отдельно s и p – орбиталей. Поэтому связь, образованная электронами гибридной орбитали характеризуется большей прочностью, чем связь, образованная электронами отдельно s - или p - орбитали.




 H- ¯ + H+ → H ¯ H
H- ¯ + H+ → H ¯ H 1S - AO первого иона-протона H+ свободна, что условно обозначается
1S - AO первого иона-протона H+ свободна, что условно обозначается

















