Двухцентровая связь может образовываться двумя путями, соответственно чему различают два механизма образования ковалентной связи.
Обменный механизм. Связующие электронные пары формируются из непарных электронов взаимодействующих атомов по схеме:

По обменному механизму образуется, например, связь в молекуле водорода, полученного при взаимодействии цинка с хлороводородной кислотой:
Zn + 2HCl = ZnCl2 + 2H·

Донорно-акцепторный механизм. Двухэлектронная связь образуется за счет свободной (вакантной) орбитали одного из атомов и неподеленной электронной пары другого атома по схеме:

При этом атом, предоставляющий для образования связи электронную пару, называется донором, а атом, предоставляющий вакантную орбиталь, - акцептором. Донорно-акцепторный механизм реализуется, в частности, в молекулах водорода, образующихся при взаимодействии хлороводородной кислоты с гидридом натрия. В данном случае катион водорода является акцептором, а гидрид-анион – донором:
HCl + NaH = NaCl + H2;

Заметим, что связи, образованные по обменному и донорно-акцепторному механизмам, отличаются лишь по происхождению общей электронной пары. По остальным характеристикам (длина связи, энергия связи, валентные углы) эти связи абсолютно идентичны. Так, в ионе NH4+ три связи N-H образованы по обменному механизму, а одна - по донорно-акцепторному, однако установить, какой из атомов водорода выступает в качестве акцептора невозможно, так как все связи в ионе аммония идентичны.
Сущность насыщаемости ковалентной связи состоит в том, что атом любого элемента может образовать лишь конечное число двухцентровых связей. Насыщаемость связи обусловлена принципом Паули, справедливым как для изолированных атомов, так и для атомов, входящих в молекулу. Количество электронов, осуществляющих ковалентную связь, не может превысить емкость энергетических подуровней, которые "задействованы" в образовании связей данным атомом. Так, например, для атома углерода (электронная конфигурация 1s22s22p2) валентными являются 2s- и 2р-подуровни; максимальное число электронов на этих уровнях равно восьми. Соответственно атом углерода не может образовывать более четырех двухцентровых связей за счет четырех электронных пар.
Представление о насыщаемости связи позволяет достаточно строго сформулировать определение валентности в соединениях с локализованными ковалентными связями. Валентность (ковалентность) - это мера способности атома к образованию связи, количественным выражением которой является число двухэлектронных связей. Двухэлектронные связи могут быть образованы атомом за счет непарных электронов, неподеленных электронных пар и вакантных орбиталей, т.е. по обменному и донорно-акцепторному механизмам.
В соответствии с этим определением рассмотрим валентные возможности элементов второго периода, для которых валентными являются 2s- и 2р-орбитали (табл. 3).
Таблица 3.
Валентные возможности элементов второго периода
| Элемент
| Распределение
электронов
| Максимальная валентность
| Примеры
соединений
|
| Обменный
механизм
| Донорно-акцепторный механизм
| Общая
|
| Li
| 
|
|
|
| Li(Sal)(HSal)*
|
| Be
|
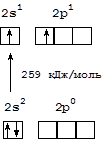
|
|
|
| [BeF4]2-
|
| B
| 
|
|
|
| [BF4]-
|
| C
| 
|
|
|
| CF4
|
| N
| 
|
|
|
| [NH4]+
|
| O
| 
|
|
|
| Be4O(Ac)6*
|
| F
| 
|
|
|
| Нет
|
| Ne
| 2s22p6
| -
|
|
| Нет
|
* HSal - салициловый альдегид C6H4(OH)CHO, Ac – ацетат-анион CH3COO-
Открывающий второй период литий, атом которого имеет один валентный электрон, может образовывать одну связь по обменному механизму, проявляя валентность, равную единице. В то же время наличие у атома лития трех вакантных орбиталей позволяет ему образовать еще три связи по донорно-акцепторному механизму, в результате чего максимальная валентность лития равна четырем. Правда, соединения четырехвалентного лития весьма немногочисленны. Подобное соединение, например, образуется при взаимодействии гидроксида лития с салициловым альдегидом:

В этой реакции в качестве доноров выступают атомы кислорода, имеющие неподеленные электронные пары.
Атом бериллия не имеет неспаренных электронов в невозбужденном состоянии и, соответственно, в таком состоянии не образует связи по обменному механизму. В то же время, формально он способен образовать четыре связи по донорно-акцепторному механизму (одну как донор и три как акцептор), но реально такая схема взаимодействия для бериллия не зарегистрирована. Однако атом бериллия легко переходит в возбужденное состояние, в котором проявляет максимальную валентность, равную четырем, так как способен образовать две связи по обменному механизму и две по дононорно-акцепторному, выступая в качестве акцептора.
Как видно из табл. 3, для всех элементов рассматриваемого периода максимальное значение валентности равно четырем. Однако эта валентность реализуется не у всех элементов. Уже кислород проявляет валентность четыре крайне редко; примером таких соединений является основной ацетат бериллия Be4O(CH3COO)6, имеющий следующее строение:

Центральный атом кислорода образует в этом соединении четыре связи с атомами бериллия. Соединения четырехвалентного фтора и тем более четырехвалентного неона не получены.
Все рассмотренные выше элементы могут проявлять валентность меньше максимальной. Так, бериллий в газообразном фториде бериллия BeF2 двухвалентен; в образовании связей в этом случае принимают участие лишь две из четырех валентных орбиталей бериллия.
В заключение, обобщая сказанное выше, сформулируем несколько общих правил, характеризующих валентность как свойство элемента.
1. Валентность элемента в ковалентных соединениях равна числу электронных орбиталей его атома, участвующих в образовании химических связей по обменному и донорно-акцепторному механизмам.
2. Максимальное значение валентности элемента не может превысить число орбиталей валентных подуровней его атома.
3. Максимальная теоретически возможная валентность элемента определяется номером периода, но не зависит от номера группы, в которой находится элемент.
3.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей
Прочность ковалентной связи зависит от степени перекрывания атомных орбиталей: чем полнее перекрывание, тем выше электронная плотность между атомами и прочнее связь. Поскольку атомные орбитали ориентированы в пространстве строго определенным образом, для максимального перекрывания электронных орбиталей необходимо, чтобы взаимодействующие атомы были должным образом ориентированы друг относительно друга. В результате образующиеся молекулы имеют определенную геометрическую форму.
В качестве примера рассмотрим строение молекулы теллуроводорода. Теллур имеет электронную конфигурацию 5s25p4. Образование связей в молекуле Н2Те происходит за счет перекрывания 1s-орбиталей двух атомов водорода с двумя 5р-орбиталями атома теллура (например, 5px и 5pz). Поскольку 5px-орбиталь направлена по оси х, а 5pz-орбиталь - по оси z, максимальное перекрывание будет наблюдаться тогда, когда ядро одного атома водорода окажется на оси х, а другого - на оси z (рис. 5а). Вследствие этого молекула теллуроводорода должна иметь угловую форму с углом между связями Те-Н, близким к 90 °. Экспериментально определенное значение валентного угла в молекуле Н2Те составляет 90,25 °. Аналогично молекула гидрида сурьмы SbH3, в которой связи образуются в результате перекрывания трех 5р-орбиталей сурьмы с 1s-орбиталями трех атомов водорода, должна иметь форму тригональной пирамиды с прямыми углами при вершине. Действительно, валентные углы для молекулы SbH3 составляют 91,6 °, т.е. весьма близки к ожидаемым (рис. 5б).

Рис. 5. Перекрывание атомных орбиталей при образовании молекул TeH2 (a) и SbH3 (б).
Более сложная картина наблюдается в том случае, когда атом предоставляет для образования связей орбитали различных подуровней. Рассмотрим это вопрос на примере молекул газообразного фторида бериллия. Атом бериллия в этом соединении образует две связи с атомами фтора по обменному механизму, что требует перехода электронной конфигурации невозбужденного атома 2s2 в конфигурацию 2s12p1. В результате можно ожидать, что связи в молекуле ВеF2 не будут равноценными, так как одна из них образуется за счет s-электрона, а вторая - за счет р-электрона. Однако в действительности обе связи в молекуле BeF2 абсолютно равноценны как по длине, так и по энергии. Аналогичное явление наблюдается для молекул BF3 и CF4, все связи в которых идентичны. Для объяснения этих и множества других подобных фактов Л. Полингом была предложена теория гибридизации электронных орбиталей.
Л. Полинг показал, что понижение энергии системы при образовании молекул становится более значительным, если волновые функции орбиталей, используемых атомом для образования связей, заменить их линейной комбинацией. Подобное "смешивание" волновых функций атома называется гибридизацией электронных орбиталей, а полученные в результате этой операции "смешанные" волновые функции - гибридными орбиталями. В результате гибридизации из нескольких отличающихся по энергии и форме орбиталей образуется такое же число одинаковых по энергии и форме граничной поверхности гибридных орбиталей. Последние ориентированы в пространстве таким образом, чтобы отталкивание между электронами было минимальным, т.е на максимальном удалении друг от друга.
Гибридные орбитали подчиняются всем квантово-механическим законам: на гибридной орбитали могут находиться не более двух электронов с антипараллельными спинами (принцип Паули), на вырожденных гибридных орбиталях электроны распределяются так, чтобы суммарный спин их был максимальным (правило Хунда).
Не все атомные орбитали могут быть гибридизованы. Устойчивая гибридизация требует соблюдения определенных условий:
1. Гибридизируемые орбитали должны быть близки по энергии. По этой причине s- и р-орбитали гибридизируются лишь тогда, когда они принадлежат одному и тому же энергетическому уровню. В случае d-орбиталей дело обстоит несколько иначе. Поскольку
(n-1)d-орбитали не слишком сильно отличаются по энергии от ns-орбиталей, возможны два варианта гибридизации:
а) Внешняя гибридизация, при которой гибридизируются s-, p- и d-орбитали, принадлежащие одному энергетическому уровню и характеризующиеся одинаковым значением главного квантового числа. В случае этого типа гибридизации d-орбитали записываются после p-орбиталей (например, sp3d2);
б) Внутренняя гибридизация с участием (n-1)d-орбиталей предвнешнего уровня и ns-, np-орбиталей. При записи данного типа гибридизации d-орбитали предшествуют s-орбиталям (например, d2sp3);
2. Гибридизируемые орбитали должны иметь достаточно высокую электронную плотность. В подгруппах периодической системы с увеличением главного квантового числа размеры орбиталей увеличиваются, а число электронов на валентных орбиталях не изменяется, в результате чего электронная плотность понижается. Поэтому в подгруппах элементов при перемещении сверху вниз способность к гибридизации атомных орбиталей убывает. Именно по этой причине в рассмотренных выше молекулах TeH2 и SbH3 связи образуются за счет p-орбиталей, а гибридизация не наблюдается.
Рассмотрим простейший тип гибридизации, являющийся результатом смешивания s-орбитали и одной р-орбитали (например, рх). Этот тип гибридизации называется sp-гибридизацией. Линейная комбинация взаимодействующих орбиталей Ys и Ypx выразится уравнением:
Ysp = c1Ys + c2Ypx,
где коэффициенты с1 и с2 определяют доли s- и р-орбиталей в полученной гибридной орбитали. Поскольку в данном случае s- и р-орбитали вносят в гибридную орбиталь одинаковые вклады, коэффициенты с1 и с2 равны по абсолютной величине, хотя могут отличаться по знаку, так как линейное комбинирование подразумевает как сложение, так и вычитание комбинируемых функций.
Подобные орбитали обладают особым свойством, называемым ортогональностью: полное перекрывание любых двух орбиталей, принадлежащих одному атому, всегда является нулевым. Чтобы убедиться в этом достаточно взглянуть на рис. 6. Области перекрывания s-орбитали каждым из лепестков рх-орбитали равны, однако для положительных значений х перекрывание положительно, а для отрицательных - отрицательно, в следствие чего полное перекрывание равно нулю. В результате гибридные орбитали приобретают форму асимметричной гантели. Такая форма обеспечивает большее перекрывание при образовании связи, чем в случае "чистых" атомных орбиталей. Поэтому образование связей с участием гибридных орбиталей энергетически более выгодно.

Рис. 6. Построение sp-гибридных орбиталей.
Как уже отмечалось, образовавшиеся гибридные орбитали ориентируются в пространстве так, чтобы силы отталкивания между находящимися на них электронами были минимальными. В случае sp-гибридизации гибридные орбитали ориентируются по одной оси в разные стороны, а угол между ними составляет 180 °. sp-Гибридизации соответствует образование линейных молекул, примером которых может служить молекула газообразного гидрида бериллия (рис. 7а).
В случае sp2-гибридизации смешиваются s- и две р-орбитали. Полученные при этом асимметричные гибридные орбитали лежат в одной плоскости, образуя равносторонний треугольник; угол между ними составляет 120°. sp2-Гибридизации подвергается, например, атом бора в молекуле ВН3, имеющей форму равностороннего треугольника (рис. 7б). Следует отметить, что молекула ВН3 нестабильна и существует лишь в газовой фазе при высокой температуре, при обычных температурах она димеризуется в диборан В2Н6.
При sp3-гибридизации из s- и трех р-орбиталей образуется четыре гибрида, направленные от центра тетраэдра к его вершинам. Валентный угол в молекулах с sp3-гибридизацией центрального атома составляет 109,5 °; примером частиц с данным типом гибридизации может служить молекула метана (рис. 7в).

Рис. 7. Строение молекул BeH2 (а), BH3 (б) и CH4 (в).
Некоторые типы гибридизации с участием d-орбиталей представлены в табл. 4, в которой приведены геометрия, значения валентных углов и примеры молекул и ионов, центральный атом которых подвергается данному типу гибридизации. Как правило, все орбитали, образующиеся при гибридизации данного типа, эквивалентны как по значениям валентных углов, так и по длине образующихся связей. Исключением является sp3d-гибридизация, в случае которой пять гибридных орбиталей образуют тригональную бипирамиду. При этом три орбитали располагаются в экваториальной плоскости (экваториальные орбитали), а две орбитали направлены перпендикулярно этой плоскости (аксиальные орбитали). Валентные углы, отвечающие этому типу гибридизации, не одинаковы (120° между экваториальными орбиталями, 180° между аксиальными орбиталями и 90° между экваториальными и аксиальными орбиталями). Связи, образованные за счет экваториальных и аксиальных орбиталей, несколько отличаются как по длине, так и по энергии. Так, в молекуле PСl5 длина связей P-Cl равна 202 пм для экваториальных и 212 пм для аксиальных орбиталей.
Таблица 4.
Некоторые типы гибридизации с участием s-, p- и d-орбиталей
| Тип
гибридизации
| Геометрия
| Валентные
углы, °
| Примеры
|
| sp
| Прямая линия
|
| BeF2
|
| sp2
| Треугольник
|
| BF3
|
| sp3
| Тетраэдр
| 109,5
| [BF4]1-
|
| d3s
| Тетраэдр
| 109,5
| [MnO4]1-
|
| dsp2
| Квадрат
| 90, 180
| [AuCl4]1-
|
| sp3d
| Тригональная
бипирамида
| 90, 120, 180
| PCl5
|
| sp3d
| Тетрагональная
пирамида
| 90, 180
| [Ni(CN)5]3-
|
| sp3d2
| Октаэдр
| 90, 180
| SF6
|
На гибридных орбиталях могут находиться неспаренные электроны и электронные пары, гибридные орбитали могут оставаться вакантными. Наличие в образовавшейся молекуле неподеленных пар на гибридных орбиталях оказывает влияние на геометрию частицы, искажая валентные углы, соответствующие данному типу гибридизации. Неподеленная пара электронов менее оттянута от ядра центрального атома, чем связывающая, находящаяся между ядрами. В связи с этим неподеленная электронная пара оказывает большее отталкивающее действие на другие электронные пары, нежели связывающая. В результате углы между орбиталями, занятыми связывающими парами, уменьшаются, а неподеленными - увеличиваются. В качестве примера рассмотрим строение молекул аммиака и воды (рис. 8). При образовании молекулы аммиака атом азота подвергается sp3-гибридизации; на четырех гибридных орбиталях распределяются пять электронов, что приводит к появлению неподеленной электронной пары; соответственно молекула аммиака имеет форму тригональной пирамиды (рис. 8а). Валентный угол, отвечающий sp3-гибридизации, должен быть равен 109,5°, однако наличие неподеленной электронной пары приводит к его сжатию до 107,3°.
Образование молекул воды также сопровождается sp3-гибридизацией орбиталей атома кислорода; две из четырех гибридных орбиталей заполняют неподленные пары, а остальные используются на образование связей О-Н по обменному механизму. В результате молекула воды имеет угловую форму, а валентный угол сжимается до 104,5°.

Рис. 8. Строение молекул NH3 (а) и H2O (б).
Когда центральный атом в молекуле использует неподеленную пару для образования связи по донорно-акцепторному механизму, сжатие валентного угла исчезает. Так, присоединение аммиаком иона водорода приводит к образованию тетраэдрического иона NH4+, все валентные углы в котором равны 109,5°.

Ион гидроксония, образующийся при присоединении иона водорода к молекуле воды, имеет форму тригональной пирамиды, для которой валентные углы НОН равны 109,0°.
При образовании молекул может наблюдаться расширение валентных углов. Это явление имеет место тогда, когда на одной из гибридных орбиталей молекулярной частицы остается неспаренный электрон. Например, атом азота в молекуле NO2, подвергается sp2-гибридизации, две гибридные орбитали используются на образование связей с атомами кислорода, а на третьей сохраняется неспаренный электрон, который слабее отталкивает связывающие электронные пары, чем неподеленная пара. В результате валентный угол в молекуле диоксида азота составляет 131°, а не 120°.
Кратность ковалентной связи
Между двумя атомами в молекуле возможно образование не только одной, но и нескольких локализованных связей. Ковалентные связи, осуществляемые двумя и более электронными парами называются кратными связями, в отличие от связи, осуществляемой одной электронной парой, называемой одинарной. Число электронных пар, связывающих два атома, называется кратностью связи.
При образовании кратных связей всегда соблюдается следующее правило: электронные облака взаимодействующих атомов, образующие кратные связи не могут перекрываться в одном и том же направлении, т.е. иметь одинаковое расположение в пространстве. Так, например, если между двумя атомами, ядра которых лежат на оси х образовалась связь в результате перекрывания двух px-орбиталей, то вторая связь за счет перекрывания s- или  -орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
-орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
В зависимости от характера перекрывания различают три вида ковалентной связи.
Сигма-связь (s-связь). Перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии, соединяющей ядра взаимодействующих атомов. s-Связь может быть образована орбиталями любого типа, если эти орбитали перекрываются по линии связи. Наиболее прочная s-связь образуется за счет гибридных орбиталей, в силу этого образованию s-связи обычно предшествует гибридизация, если последняя возможна. На рис. 9а приведены примеры перекрывания атомных орбиталей, приводящие к образованию s-связей.
Пи-связь (p-связь). Перекрывание орбиталей происходит в направлении, перпендикулярном линии связи (боковое перекрывание). Образующееся при этом связывающее электронное облако имеет плоскость, включающую линию связи и одну из координатных осей. Поскольку линии связи перпендикулярны две оси, между атомами могут возникнуть две p-связи, для которых электронные облака не будут пространственно совмещаться. p-Связь может образовываться за счет р- и d-орбиталей (рис. 9б). Прочность p-связи меньше прочности s-связи, тем не менее образование p-связей дополнительно стабилизирует молекулу.

Рис. 9. Перекрывание электронных орбиталей при образовании s- (а), p- (б) и
d-связей (в).
Дельта-связь (d-связь). Перекрывающиеся орбитали расположены в двух параллельных плоскостях, перпендикулярных линии связи. d-Связь может образоваться в результате перекрывания  -орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.
-орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.
В качестве примера соединения с s- и p-связями можно привести молекулу азота N2. Атом азота, имеющий электронную конфигурацию 1s22s22p3, характеризуется наличием на валентных энергетических подуровнях электронной пары и трех неспаренных электронов. Наиболее выгодным типом гибридизации в данном случае является sp-гибридизация, при которой сохраняются две "чистые" р-орбитали, обеспечивающие образование двух p-связей:
½¾¾¾¾¾®½
sp-гибридизация
На двух sp-гибридных орбиталях каждого атома азота распределяются три электрона (электронная пара и неспаренный электрон); электронные пары остаются неподеленными, а непарные электроны образуют s-связь, направленную по оси х. Неспаренные электроны образуют две p-связи, ориентированные взаимно перпендикулярно. Структура молекулы :NºN: приведена на рис. 10.

Рис. 10. Строение молекулы азота.
d-Связь реализуется значительно реже, чем s- и p-связи. Примером соединения с d-связью может служить ион [Re2Cl8]2-:









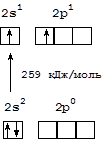












 -орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
-орбиталей возникнуть не может, так как эти орбитали перекрываются в том же направлении, что и px-орбитали.
 -орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.
-орбиталей взаимодействующих атомов, если линией связи является ось z (рис. 9в); при этом между двумя атомами возможно образование только одной d-связи. Таким образом, максимальная теоретически возможная кратность связи между двумя атомами равна четырем: одна s-, две p- и одна d-связь.



