

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
В.И. СКВОРЦОВА
№ 15-0/10/2-11336 от 16.11.2011 г.
МЕТОДИЧЕСКОЕ ПИСЬМО
Интенсивная терапия и принципы выхаживания детей с экстремально низкой и очень низкой массой тела при рождении
Методическое письмо подготовлено сотрудниками ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова» (директор – акад. РАМН Г.Т.Сухих) Минздравсоцразвития России: А.Г. Антоновым, О.В. Ионовым, Д.С. Крючко. А.А. Ленюшкиной, А.Ю. Рындиным; специалистами Департамента развития медицинской помощи детям и службы родовспоможения Минздравсоцразвития России О.С. Филипповым, О.В. Чумаковой, Ю.Е. Тереховой.
Под редакцией профессоров Е.Н. Байбариной, Д.Н. Дегтярева и директора Департамента развития медицинской помощи детям и службы родовспоможения Минздравсоцразвития России В.И. Широковой.
Рецензенты:
Заведующий кафедрой неонатологии ГБОУ «Российская медицинская академия последипломного образования» Минздравсоцразвития России, д.м.н., профессор М.С. Ефимов; заведующая отделом неонатологии ФГБУ «Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова» Минздравсоцразвития России, д.м.н., профессор, заслуженный врач Российской Федерации Т.В. Чаша.
Введение
Переход на новые технологии выхаживания глубоко недоношенных детей, родившихся с экстремально низкой (ЭНМТ) и очень низкой массой тела (ОНМТ), является одной из приоритетных задач, поставленных перед практическим здравоохранением Правительством Российской Федерации.
Методическое письмо предназначено для специалистов, в чьи функциональные обязанности входит оказание специализированной медицинской помощи новорожденным детям.
|
|
Особенности оказания первичной реанимационной помощи в родильном зале
Профилактика гипотермии в родильном зале у недоношенных новорожденных. Дифференцированный подход в зависимости от массы тела/ срока гестации. Правила и техника использования полиэтиленового мешка или пленки у детей с ЭНМТ.
Профилактика гипотермии является одним из ключевых элементов выхаживания критически больных и глубоконедоношенных детей.
При ожидающихся преждевременных родах температура в родильном зале должна составлять 26-28С. Основные мероприятия по обеспечению тепловой защиты проводятся в первые 30 секунд жизни в рамках начальных мероприятий первичной помощи новорожденному.
Объем мероприятий профилактики гипотермии различается у недоношенных детей массой тела более 1000 г (срок гестации более 28 недель) и детей массой тела менее 1000 г (срок гестации менее 28 недель).
У детей, родившихся на сроке гестации более 28 недель, также как и у более зрелых новорожденных, используется стандартный объем профилактических мероприятий: обсушивание кожных покровов и обертывание в теплые сухие пеленки. Однако учитывая значительно более высокий риск гипотермии у глубоконедоношенных детей, стандартные мероприятия требуют особой тщательности выполнения. Поверхность головы ребенка дополнительно защищается от теплопотери при помощи пеленки или шапочки. На остаток пуповины накладывается зажим, обработка остатка пуповины откладывается до поступления ребенка в отделение интенсивной терапии.
Для контроля эффективности проводимых мероприятий и профилактики гипертермии всем недоношенным детям рекомендуется проводить непрерывный мониторинг температуры тела в родильном зале, а также фиксировать температуру тела ребенка при поступлении в блок интенсивной терапии.
Профилактика гипотермии у недоношенных детей, родившихся до завершения 28-й недели гестации, предусматривает обязательное использование пластиковой пленки (пакета).
|
|
Дозировка сурфактанта
Для получения эффекта требуется введение не менее 100 мг/кг сурфактанта, хотя получены фармакологические и клинические данные, свидетельствующие о том, что сурфактант в стартовой дозе 200 мг/кг имеет более длительный период полужизни и оказывает более выраженный и быстрый эффект. В соответствии с Европейскими рекомендациями по ведению РДС у недоношенных пересмотра 2010 года, порактант альфа в начальной дозе 200 мг/кг оказывает лучший эффект, чем порактант альфа в дозе 100 мг/кг или берактант для лечения среднетяжелого и тяжелого РДС.
При наличии показаний наиболее эффективным считается введение сурфактанта в первые 15 минут жизни ребенка. В родильном зале могут использоваться два основных метода введения: через боковой порт интубационной трубки (без размыкания контура ИВЛ) и при помощи катетера, вводимого в ЭТТ с размыканием дыхательного контура. Техника введения при этом практически не различается.
Техника введения сурфактанта в родильном зале.
1. Измерить длину ЭТТ.
2. При использовании техники введения при помощи катетера - отрезать стерильными ножницами катетер на 0,5-1 см короче длины ЭТТ.
3. Проверить глубину расположения ЭТТ выше бифуркации трахеи; проконтролировать симметричность аускультативной картины и отметку длины ЭТТ у угла рта ребенка (от 6 до 7 см, в зависимости от предполагаемой массы тела).
4. Ввести сурфактант через катетер или боковой порт ЭТТ быстро болюсно. Болюсное введение обеспечивает наиболее эффективное распределение сурфактанта в легких. У детей массой тела менее 750г допустимо разделить препарат на 2 равные части, которые следует ввести одну за другой с интервалом в 1-2 минуты.
5. Под контролем SрO2 снизить параметры ИВЛ. Снижение параметров следует проводить быстро, так как изменение эластических свойств легких после введения сурфактанта происходит уже в течение нескольких секунд, что может спровоцировать гипреоксический пик и венлитятор-ассоциированное повреждение легких. В первую очередь следует снизить давление на вдохе, затем (при необходимости) – концентрацию дополнительного О2 до минимально достаточных цифр, необходимых для достижения SpO2 91-95%. Как правило, после эффективного введения сурфактанта удается снизить давление на вдохе до 16-20 см Н20 (у крайне незрелых детей – до 14-16 см Н20), концентрацию О2 - до 21%.
|
|
* В зарубежных источниках термин «профилактическое введение сурфактанта» подразумевает все случаи введения в первые 15 минут жизни. Европейские рекомендации по ведению РДС пересмотра 2010 года предусматривают профилактическое применение сурфактанта у детей менее 26 недель гестации, а также у всех недоношенных с клиникой РДС, потребовавших интубации в родильном зале.
Таблица 1
Таблица 2
Целевые показатели оксигенации крови (по данным SpO2) глубоко недоношенных детей в первые 10 минут жизни
| Время от рождения | Целевые показатели SpO2. | Алгоритм изменения концентрации дополнительного О2 под контролем показателей пульсоксиметрии. При нахождении показателей ребенка за пределами указанных значений, следует изменять (увеличивать/ уменьшать) концентрацию дополнительного О2 ступенчатона 10-20% каждую последующую минуту до достижения целевых показателей и /или ЧСС более 100. |
| 1 мин | 60-65% | |
| 2 мин | 65-70% | |
| 3 мин | 70-75% | |
| 4 мин | 75-80% | |
| 5 мин | 80-85% | |
| 10 мин | 85-95% |
Таблица 5
Калибровка датчика in vivo
Данный вид калибровки рекомендуется применять с целью коррекции показателей tc p O2 и tc p CO2 по результатам анализа газов артериальной крови. В результате показатели tc p O2/tc p CO2 приближаются к реальным значениям в артериальной крови, однако это не означает, что прибор показывает именно артериальные pO2 и pCO2. Корректировка осуществляется чисто арифметически, поэтому ее необходимо обновлять при следующем анализе проб артериальной крови.
Примечания:
не следует применять калибровку in vivo у гемодинамическинестабильныхпациентов, т.к. разница между чрескожными значениями и концентрацией газов в артериальной крови может значительно колебаться;
можно применять калибровку in vivo по значениям капиллярной (артериализованной) крови, но следует учитывать значительное отличие показателей p O2 и p CO2 капиллярной и артериальной крови.
иногда применяется калибровка in vivo по значениям венозной пробы, но она проводится только для параметра p CO2, т.к. показатели p O2 артериальной и венозной крови отличаются значительно.
|
|
Наиболее объективным методом мониторинга газового состава крови является комбинация чрезкожного измерения tcpO2 и определения уровня насыщения гемоглобина кислородом (пульсоксиметрия) с периодическим взятием проб артериальной крови для определения концентрации газов и лактата. Пульсоксиметрия обеспечивает быструю реакцию на изменения в поглощении и транспорте кислорода. Величина tcpO2 предоставляет информацию о доставке кислорода к тканям. Пробы артериальной крови необходимы для коррекции показателей, измеренных неинвазивно, и формирования более четкого представления о газовом гомеостазе пациента.
Референтные значения КОС, p O2 и p CO2 артериальной, смешанной венозной и венозной крови у новорожденных детей, измеренные инвазивным способом представлены в таблицах 6-8.
Таблица 6.
Референтные значения КОС, газов капиллярной крови у новорожденных.
| Показатели | N | Среднее | SD | 2.5%-иль | 97.5%-иль |
| pH | 7,395 | 0,037 | 7,312 | 7,473 | |
| p CO2 (mm Hg) | 38,7 | 5,1 | 28,5 | 48,7 | |
| p O2 (mm Hg) | 45,3 | 7,5 | 32,8 | 61,2 | |
| Лактат (mmol/L) | 2,6 | 0,7 | 1,4 | 4,1 | |
| Hb (g/L) | |||||
| Глюкоза (mmol/L) | 3,8 | 0,8 | 2,1 | 5,3 | |
| iCa (mmol/L) | 1,21 | 0,07 | 1,06 | 1,34 |
Таблица 7.
Референтные значения КОС, p O2 и p CO2 артериальной, смешанной венозной и венозной крови у новорожденных детей.
| Показатели | Артериальная кровь | Смешанная венозная кровь | Венозная кровь |
| pH (диапазон) | 7,4 (7,37-7,44) | 7,36 (7,31-7,41) | 7,36 (7,31-7,41) |
| p O2 (mm Hg) снижается с возрастом | 80-100 | 35-40 | 30-50 |
| p CO2(mm Hg) | 36-44 | 41-51 | 40-52 |
| SatO2 (%) | >95 | 60-80 | 60-85 |
| HCO3- (mmol/l) | 22-26 | 22-26 | 22-28 |
| Избыток оснований (дефицит/избыток) | -2/+2 | -2/+2 | -2/+2 |
Таблица 8.
Разница показателей КОС, p O2 и p CO2 артериальной и венозной крови у новорожденных.
| Артериальная кровь | АВ разница | Венозная кровь | |
| pH | 7,40 | 0,2 | 7,38 |
| p CO2 mmHg | 39,8 | 5,3 | 45,1 |
| p O2 mmHg | 97,7 | 60,1 | 37,6 |
Периферический сосудистый доступ для забора крови на лабораторные анализы, проведения лекарственной и инфузионной терапии используется органиченно, поскольку такой подход способствует защите целостности кожного покрова, уменьшению болезненности манипуляций и соответствует концепции охранительного режима.
Новорождённые с ЭНМТ и ОНМТ предрасположены к значительным потерям жидкости вследствие повышенного испарения через кожу и респираторный тракт, низкой концентрационной способности почек, сниженной толерантности к инфузии растворов глюкозы, вследствие чего часто возникает гипергликемия и осмотический диурез. Возникающая в результате гипертоническая дегидратация — один из основных факторов риска ВЖК.
Согласно литературным данным, величина транзиторной потери массы тела у глубоконедоношенных новорождённых варьирует в пределах 5–25% и зависит не столько от степени зрелости, сколько от условий выхаживания и объёма инфузионной терапии. В повседневной практике следует стремиться к тому, чтобы максимальные потери массы тела у детей с ЭНМТ в первую неделю жизни не превышали 10–15%.
|
|
Долженствующий объём жидкости в первую неделю жизни детей с ЭНМТ рассчитывают, исходя из предполагаемой величины неощутимых потерь, диуреза, потерь воды со стулом. Ориентировочные потребности в жидкости детей с ЭНМТ (Табл.9) на первой неделе жизни, выхаживание которых проводят в условиях кувеза, представлены в табл. Начиная со 2–3-й недели жизни к этим цифрам прибавляют 15–30 мл/кг на обеспечение прибавки массы тела.
Таблица 9
Ориентировочные потребности детей с ЭНМТ в жидкости
| Количество выводимой жидкости, мл/(кг | Количество необходимой жидкости мл/кг/сут | ||||
| 1-е сутки жизни | 2–3 сутки жизни | 4–5-е сутки жизни | 6–7-е сутки жизни | ||
| Неощутимые потери жидкости | 40–170 | 80-90 | 100–120 | 130–150 | 150–180 |
| Моча | 30–100 | ||||
| Стул | 5–10 | ||||
| Всего | 75–280 |
Основная причина повышенной потребности в жидкости детей с ЭНМТ в первые дни жизни - большая величина неощутимых потерь жидкости, причина которых - увеличение соотношения площади поверхности тела к весу и несостоятельная барьерная функция эпидермиса.
Величина неощутимых потерь жидкости напрямую зависит от гестационного возраста (чем меньше гестационный возраст, тем больше неощутимые потери жидкости) и от постнатального возраста (по мере созревания барьерной функции кожи величина неощутимых потерь жидкости снижается).
Неощутимые потери жидкости, обусловленные, в первую очередь, испарением с кожи, в меньшей степени - со слизистой дыхательных путей, в течение первой недели жизни могут достигать 5–7 мл/(кг/ч).
Ежесуточная потребность в жидкости существенно изменяется, если имеется дополнительный источник патологических потерь жидкости, имеются факторы, изменяющие величину неощутимых потерь жидкости, диурез превышает 2,5–5 мл/(кг/ч).
Как и у других категорий новорождённых, для оценки водно-электролитного баланса у детей с ЭНМТ в обязательном порядке оценивают почасовой диурез, динамику массы тела и уровень сывороточного натрия (наиболее чувствительный индикатор гипертонической дегидратации).
В первую неделю массу тела ребёнка следует измерять каждые 12 ч, хотя в отдельных клинических ситуациях (крайняя степень тяжести состояния ребёнка при отсутствии встроенных в кювез весов) может послужить поводом для отказа от частых взвешиваний при условии адекватного увлажнения воздуха и контроля почасового диуреза.
Сывороточный уровень электролитов у новорождённых с ЭНМТ подвержен резким значительным колебаниям, что требует регулярного (каждые 24–48 ч) контроля и своевременной коррекции. Сразу после рождения скорость клубочковой фильтрации и фракционная экскреция натрия снижены, вследствие чего возникает олигурия. В первые 24–48 ч новорождённые с ЭНМТ, как правило, не нуждаются в назначении препаратов калия, натрия и хлора.
Энтеральное и парентеральное питание детей с ЭНМТ и ОНМТ
Обобщенные рекомендации по проведению полного парентерального питания новорожденным с ЭНМТ и ОНМТ.
При проведении парентерального питания еще совсем недавно доминировала стратегия так называемой «традиционной дотации нутриентов», предусматривающая начало поступления аминокислот со 2-3 суток жизни с последующим добавлением жировых эмульсий и постепенное (в течение первой недели жизни) достижение конечных целевых значений поступления всех нутриентов, не отвечающее затратам недоношенного ребенка на пластические и энергетические нужды. Возникающий при этом дефицит нутриентов способен привести к задержке роста и нарушению формирования ЦНС.
Чтобы избежать указанных недостатков и добиться внутриутробной скорости роста у глубоконедоношенного ребенка, в последние годы используется стратегия «форсированной дотации нутриентов», основные принципы которой изложены ниже.
1. У новорожденных в стабильном состоянии дотацию аминокислот начинают в 1-е сутки в стартовой дозе 1,5-2 г/кг/сут. Прибавляя по 0,5-1 г/кг/сут, достигают уровня 3,5-4 г/кг/сут. У новорожденных с сепсисом, асфиксией, выраженными нарушениями гемодинамики, декомпенсированным ацидозом начальная доза аминокислот составляет 1 г/кг/сут, темпы прибавки- 0,25-0,5 г/кг/сут под контролем КОС, показателей гемодинамики, диуреза. Абсолютными противопоказаниями для начала и продолжения инфузии аминокислот являются: шок, ацидоз с рН менее 7,2, гиперкапния рСО2 более 80 мм рт.ст.
2. Для оптимального усвоения белка каждый грамм вводимых аминокислот по возможности обеспечивают энергией из соотношения 25 небелковых ккал/г белка, оптимально - 35-40 ккал/г белка. В качестве энергетического субстрата используется комбинация глюкозы и жировых эмульсий 1:1.
3. Стартовая скорость внутривенной инфузии глюкозы должна составлять 4-6 мг/кг/мин, что соответствует скорости эндогенной утилизации глюкозы у плода. Если возникает гипергликемия, скорость поступления глюкозы снижают до 4 мг/кг/мин. При сохраняющейся гипергликемии необходимо проконтролировать наличие поступления аминокислот в адекватной дозировке и рассмотреть возможность уменьшить скорость инфузии жировой эмульсии. Если гипергликемия персистирует, начинают инфузию инсулина со скоростью 0,05-0,1 ЕД/кг/час одновременно с повышением скорости введения глюкозы до 6 мг/кг/мин. Скорость инфузии инсулина регулируют каждые 20-30 минут до достижения сывороточного уровня глюкозы 4,4-8,9 ммоль/л.
4. Верхний предел количества вводимой внутривенно глюкозы – 16-18 г/кг/сут.
5. У детей с ЭНМТ в стабильном состоянии дотация жира может быть начата на 1-3 день жизни (как правило, не позднее 3-х суток) в дозе 1 г/кг/сут, для крайне незрелых новорожденных – с 0,5 г/кг/сут. Дозу увеличивают ступенчато на 0,25-0,5 г/кг/сут до достижения 3 г/кг/сут. Ступенчатое повышение дозы жиров не увеличивает их переносимость, однако позволяет мониторировать уровень триглицеридов, отражающий скорость утилизации субстрата. В качестве индикатора может также использоваться тест на прозрачность сыворотки. У новорожденных в критическом состоянии (сепсис, тяжелый РДС), а также при уровне билирубина более 150 мкмоль/л в первые трое суток жизни дозировка жировых эмульсий не должна превышать 0,5-1 г/кг/сут. Любые изменения в дотации жира в этих случаях должны мониторироваться измерением сывороточного уровня триглицеридов. Жировые эмульсии назначаются в виде пролонгированной инфузии 20% раствора равномерно в течение суток. Максимальная доза вводимых внутривенно жиров составляет 4 г/кг/сут.
6. Целевые показатели дотации белка и энергии при полном парентеральном питании у детей с ЭНМТ составляют: 3,5-4 г/кг аминокислот и 100-120 ккал/кг энергии.
7. Полное парентеральное питание у детей с ЭНМТ всегда по возможности должно сочетаться с минимальным энтеральным питанием.
Энтеральное питание
Общепринятым при выхаживании детей ЭНМТ является принцип раннего (оптимально – в первые 24 часа) «минимального» энтерального (трофического) питания, назначаемого в объеме, не превышающем 5-25 мл/кг/сут. Доказано, что даже небольшие объемы питания способны оказывать позитивное влияние на функциональное созревание желудочно-кишечного тракта, не увеличивая при этом риск развития энтероколита. Преимуществами раннего «минимального» энтерального питания перед поздним являются: уменьшение длительности полного парентерального питания, выраженности признаков холестаза и лучшая толерантность новорожденного к пищевой нагрузке в течение неонатального периода.
Признаки, свидетельствующие о готовности ребенка с ЭНМТ к энтеральному питанию, включают в себя: отсутствие вздутия живота, наличие перистальтики, отсутствие желчи в желудочном содержимом, отсутствие признаков желудочного кровотечения.
Противопоказаниями к раннему началу энтерального питания являются: шок, желудочное кровотечение, подозрение на атрезию пищевода и другие пороки развития, несовместимые с энтеральным вскармливанием.
Наличие прокрашивания желудочного содержимого желчью или зеленью без других признаков непереносимости питания не является противопоказанием к началу и наращиванию объема энтерального питания.
Допустимый объем остаточного содержимого желудка определяется как объем, поступающий в течение одного часа капельного кормления (или 50% объема одного кормления). Измерение объема остаточного содержимого при капельном кормлении проводится через 1 час с момента прекращения инфузии.
Пролонгированное капельное поступление пищевого субстрата имеет при вскармливании детей с ЭНМТ преимущества перед болюсным питанием. Поступление молока распределяется равномерно в течение суток без перерыва или – с одно- двухчасовыми перерывами между кормлениями. Канюля шприца при проведении капельного питания должна быть приподнята на 45 градусов для предотвращения потери жиров.
Оптимальным субстратом для энтерального питания ЭНМТ является нативное материнское молоко. Среди преимуществ нативного молока можно отметить: более быструю эвакуацию из желудка, лучшее всасывание жиров, большую частоту стула, снижение риска возникновения сепсиса и некротизирующего энтероколита, лучшее психомоторное и интеллектуальное развитие новорожденных. Необходимым условием использования нативного материнского молока у детей с ОНМТ и ЭНМТ является его мультикомпонентное обогащение.
При отсутствии материнского молока рекомендуется специализированная смесь для недоношенных.
В последние годы широкое распространение получила двухэтапная система искусственного вскармливания глубоконедоношенных новорожденных, которая предусматривает повышенное поступление нутриентов у детей самого низкого гестационного возраста и массы тела менее 1800г с последующим переходом на менее богатое нутриентами питание соответственно убывающим потребностям. Двухэтапная система предусматривает наличие двух специализированных смесей – стартовой для детей до 1800г и последующей – для детей от 1800г. Применеие последующей смеси по показаниям может пролонгироваться до 6-12 мес жизни, пока ребенок не достигает 25-й перцентили по показателям физического развития для своего возраста. При длительном применении специализированной последующей смеси у недоношенных детей к возрасту 1 года отмечаются более высокте показатели минерализации костной ткани.
Широкое применение смесей на основе гидролиза белка в настоящее время не доказало значимых клинических преимуществ у детей с ОНМТ и ЭНМТ. Использование смесей – гидролизатов у детей с ОНМТ и ЭНМТ допустимо лишь в том случае, если такой продукт специально разработан для вскармливания недоношенных.
Примерный протокол энтерального питания
Новорожденных с ЭНМТ
Основные положения:
· Начало энтерального питания – в первые 24 часа жизни
· Приоритет вскармливания материнским молоком, альтернатива- смесь для недоношенных
· Стремление к достижению полного объема энтерального питания в возрасте 3-х недель жизни
Рекомендации для новорожденных массой тела <750г:
· Начальный объем-0,5 мл болюсно каждые 6 часов, продолжить в течение 48 часов
· Далее прибавлять по 0,5 мл на кормление каждые 24 часа
· После 72 часов хорошей переносимости питания перейти на капельное введение по схеме 2 часа инфузии -1 час перерыв и прибавлять по 0,5мл на кормление каждые 12 часов до максимального объема 160 мл/кг/сут
· Добавить фортификатор по достижении объема 100 мл/кг
Рекомендации для новорожденных массой тела 751-1000г:
· Начальный объем-1-2 мл болюсно каждые 3 часа, продолжить в течение 24-48 часов
· При хорошей переносимости перейти на капельное введение по схеме 2 часа инфузии -1 час перерыв прибавлять по 1 мл на кормление каждые 12 часов до максимального объема 160 мл/кг/сут
· Добавить фортификатор по достижении объема 100 мл/кг
Защита кожи
Травматизация эпидермиса у глубоконедоношенных детей сопряжена с высоким риском инфицирования, поэтому любую манипуляцию, затрагивающую кожу новорождённого с ЭНМТ, следует критически оценивать с учетом соотношения риска и пользы. Рутинная обработка кожи в родильном зале не проводится. В дальнейшем обработку кожи следует проводить крайне бережно, только при наличии показаний (внешнее загрязнение, присутствие дефектов кожи, пролежней, необходимость антисептической обработки перед инвазивными манипуляциями).
Рутинное применение смягчающих средств показано в первую неделю жизни только в случаях, когда по техническим или иным причинам невозможно создание высокой влажности в инкубаторе. Для местной антисептической обработки кожи препаратами выбора являются водные растворы антисептиков и специальные антисептики, предназначенные для обработки слизистых оболочек (например, 0,01–0,05% водный раствор хлоргексидина и антисептик для слизистых). Экспозиция антисептика должна составлять не менее 30 с, аппликацию выполняют последовательно двукратно. После выполнения процедуры антисептик следует полностью смыть стерильной водой или физиологическим раствором для предотвращения абсорбции через кожу. Для ухода за кожей глубоконедоношенного ребёнка используются смягчающие средства на основе ланолина или вазелина (например, чистый обезвоженный ланолин в аптечной расфасовке или мазь декспантенола на ланолиновой основе). Принимая во внимание вероятность системной абсорбции, препарат не должен содержать красителей, отдушек и активных ингредиентов.
Для мониторинга предпочтительно использовать электроды на низкопрофильной основе из микропористой ткани с твёрдым гелем. При креплении на кожу температурных датчиков, желудочных зондов, дренажей и других приспособлений, а также в местах повышенного трения показано использование воздухопроницаемой полиуретаново-акриловой адгезивной пленки или атравматичного лейкопластыря. Перед снятием любых приспособлений с адгезивной поверхностью их предварительно смачивают водой или стерильным растительным маслом. Мочеприемники и другие приспособления с большой площадью крепления (например, датчики транскутанного мониторинга газов крови) у новорождённых менее 30 нед гестации в первую неделю жизни применять нежелательно.
Таблица 10
Уход за детьми на СДППД
Традиционная ИВЛ
Проведение ИВЛ у детей с ЭНМТ основано на концепции минимальной инвазивности. Эта концепция, в свою очередь, основана на двух положениях. Первое – использование стратегии “защиты легких”, а второе – по возможности быстрый перевод на неинвазивную респираторную терапию.
Стратегия «защиты легких» заключается в поддержании альвеол в расправленном состоянии на всем протяжении дыхательной терапии. С этой целью устанавливается РЕЕР 4-5 см Н2О. Второй принцип стратегии «защиты легких» заключается в дотации минимально достаточного дыхательного объема, что предотвращает волютравму. Для этого следует подбирать пиковое давление под контролем дыхательного объема. Для корректной оценки используется дыхательный объем выдоха, так как именно он участвует в газообмене. Пиковое давление подбирается таким образом, чтобы дыхательный объем выдоха был 4-6мл/кг.
Порядок проведения ИВЛ
После установки дыхательного контура и калибровки аппарата ИВЛ следует выбрать режим вентиляции.
У недоношенных предпочтительно использовать триггерную ИВЛ, в частности, режим assist/control. В этом режиме каждый вдох будет поддерживаться респиратором. Если самостоятельного дыхания нет, то режим А/С автоматически становится режимом принудительной вентиляции - IMV при установке определенной аппаратной частоты дыхания.
В редких случаях режим А/С может оказываться избыточным для ребенка, когда несмотря на все попытки оптимизировать параметры, ребенок имеет стойкую гипокапнию из-за тахипноэ. В этом случае можно перевести ребенка в режим SIMV и установить желаемую частоту респиратора.
Поскольку у маловесных пациентов преимущественно используются интубационные трубки малого диаметра, то актуальной становится проблема высокой аэродинамической резистентности дыхательных путей. Для снижения аэродинамического сопротивления интубационной трубки следует ее подрезать и оставлять не более 1-2 см от края губ ребенка. Кроме того, в этой ситуации целесообразно использовать вместо ИВЛ ограниченной по давлению (Pressure limited), вентиляцию с контролем по давлению (Pressure control). При вентиляции в режиме pressure control скорость потока автоматически определяется аппаратом и варьирует в зависимости от инспираторной потребности пациента. Это облегчает вдох и снижает работу дыхания у маловесных пациентов.
После того как режимы выбраны, до подключения ребенка к аппарату устанавливаются стартовые параметры ИВЛ.
Стартовые параметры ИВЛ у маловесных пациентов:
FiO2 – FiO2 – 0,3- 0,4 (обычно на 5-10% больше чем при СРАР)
Тin – 0,3-0,4 сек
РЕЕР - + 4 - 5 см вод. ст.;
ЧД - В режиме assist/control (A/C) частота дыхания определяется пациентом.
Аппаратная частота устанавливается 30 - 35 и является лишь страховкой на случай апноэ у пациента.
В режиме SIMV и IMV устанавливается частота физиологическая – 40-60 в минуту.
PIP обычно устанавливается в диапазоне 14-20 см вод. ст.
Поток – 5-7 л/минуту при использовании режима «pressure limited». В режиме «pressure control» поток устанавливается автоматически.
После подключения ребенка к аппарату ИВЛ проводится оптимизация параметров:
FiO2 устанавливается таким образом, чтобы уровень сатурации был в пределах 91-95%. При наличии в аппарате ИВЛ функции автоматического подбора FiO2 в зависимости от уровня сатурации у пациента ее целесообразно использовать для профилактики гипоксических и гипроксических пиков, что в свою очередь является профилактикой бронхолегочной дисплазии, ретинопатии недоношенных, а так же структурных геморрагических и ишемических повреждений головного мозга.
Время вдоха является динамическим параметром. Время вдоха зависит от заболевания, его фазы, от частоты дыхания самого пациента и некоторых других факторов. Поэтому при использовании привычной тайм-циклической вентиляции время вдоха желательно устанавливать под контролем графического мониторинга кривой потока (рис. 6). Устанавливать время вдоха следует так, чтобы на кривой потока выдох являлся бы продолжением вдоха. Не должно быть паузы вдоха в виде задержки кривой на изолинии, и в то же время выдох не должен начинаться раньше, чем закончится вдох.
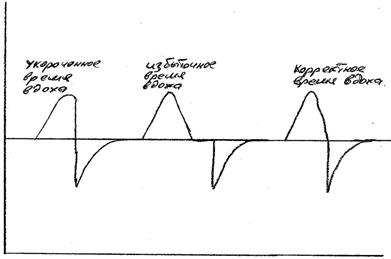
Рис 6. Подбор времени вдоха по кривой потока
При использовании вентиляции, цикличной по потоку время вдоха будет определяться самим пациентом в случае наличия у ребенка самостоятельного дыхания. Такой подход имеет некоторое преимущество, так как позволяет глубоко недоношенному пациенту самому определять комфортное время вдоха. В этом случае время вдоха будет варьировать в зависимости от частоты дыхания пациента, его инспираторной активности. Вентиляция, цикличная по потоку, может использоваться в ситуациях, когда у ребенка присутствует самостоятельное дыхание, нет выраженной экссудации мокроты и отсутствует склонность к ателектазированию. При проведении вентиляции, цикличной по потоку, необходимо мониторировать фактическое время вдоха пациента. В случае формирования неадекватно короткого временя вдоха, такой пациент должен быть переведен в режим тайм-циклической ИВЛ и вентилироваться с заданным, фиксированным временем вдоха.
Оптимизация Pip проводится таким образом, чтобы дыхательный объем выдоха был в диапазоне 4-6мл/кг. При наличии в аппарате ИВЛ функции автоматического подбора пикового давления в зависимости от дыхательного объема пациента, ее целесообразно использовать у тяжелых пациентов с целью профилактики ИВЛ ассоциированного повреждения легких.
Регулировка параметров ИВЛ
Таблица 11.
Схематичная регулировка параметров в зависимости от газового состава крови:
| Низкий PaO2 | Высокий РaO2 | Низкий PaCO2 | Высокий PaCO2 |
| Увеличить Реер | Уменьшить РIP | Уменьшить Vt (PIP) | Увеличить ЧД |
| Увеличить FiO2 | Уменьшить FiO2 | Уменьшить ЧД | Увеличить Vt (PIP) |
| Увеличить РIP | Уменьшить Реер |
Основная коррекция параметров вентиляции заключается в своевременном снижении или повышении пикового давления в соответствии с изменениями дыхательного объема (Vt). Следует поддерживать Vt в пределах 4-6мл/кг, увеличивая или уменьшая Pip. Превышение этого показателя приводит к повреждению легких и увеличению сроков пребывания ребенка на аппарате ИВЛ.
При регулировке параметров необходимо помнить, что:
1. Основными агрессивными параметрами ИВЛ, которые следует снижать в первую очередь, являются: PIP (Vt). и FiO2 (> 40%).
2. За один раз давление меняется не более чем на 1-2смН2О, а частота дыхания не более чем на 5 вдохов (в режиме SIMV и IMV). В режиме assist control изменение частоты бессмысленно, так как в этом случае частота вдохов определяется пациентом, а не аппаратом ИВЛ.
3. FiO2 следует менять под контролем SpO2 ступенчато на 5-10%.
4. Гипервентиляция (р.CO2<35 мм.ст.ст) у ЭНМТ ассоциирована с высоким риском БЛД и с плохим неврологическим исходом, а высокие цифры рСО2, напротив – со снижением риска БЛД. В соответствии с этим широкое распространение получила стратегия допустимой (пермиссивной) гиперкапнии, которая заключается в поддержании значений СО2 до 65 мм.рт.ст, обеспечивающих уровень рН более 7,25. Эпидемиологические исследования, подтвержденные в экспериментах с животными, свидетельствуют о том, что респираторный ацидоз, в отличие от метаболического, не ассоциирован с плохим неврологическим исходом.
Динамика режимов ИВЛ:
Если не удается экстубировать пациента с режима assist control в первые 3-5 суток, то следует перевести ребенка в режим SIMV с поддержкой давлением (PSV). Этот маневр позволяет уменьшить суммарное среднее давление в дыхательных путях и таким образом снизить инвазивность ИВЛ.
Таким образом, заданная частота вдохов пациента будет осуществляться с давлением на вдохе, устанавливаемом таким образом, чтобы дыхательный объем был в пределах 4-6мл/кг. Давление поддержки остальных спонтанных вдохов (PSV) следует устанавливать таким образом, чтобы дыхательный объем соответствовал нижней границе – 4 мл/кг. Т.е. вентиляция в режиме SIMV+PSV проводится с двумя уровнями давления на вдохе – оптимальным и поддерживающим.
Уход от ИВЛ осуществляется путем снижения принудительной частоты респиратора, что ведет к постепенному переводу ребенка на режим PSV, с которого и осуществляется экстубация на неинвазивную вентиляцию или СРАР.
В случаях массивной мекониальной аспирации, утечки воздуха из легких, очаговой пневмонии, бронхообструктивном синдроме и других случаях неравномерной вентиляции в легких следует перевести ребенка в режим Pressure limited, при котором скорость потока устанавливается врачом, а нарастание давления в дыхательных путях более плавное, чем в режиме pressure control. В условиях аэродинамической неоднородности дыхательных путей режим с постоянной, заданной скоростью потока обеспечивает более равномерную вентиляцию чем режим с вариабельной скоростью потока.
Экстубация.
В настоящий момент известно, что подавляющее больш<
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!