

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Когезия
С межфазным поверхностным натяжением так или иначе связаны все поверхностные явления. В этой главе мы рассмотрим некоторые из них, связанные с взаимодействием молекул внутри отдельной фазы и при контакте разнородных фаз.
Притяжение друг к другу (сцепление) частиц вещества - атомов, молекул, ионов - внутри одной фазы называется когезией (от лат. cohaesus – связанный, сцепленный). Когезия обусловлена межмолекулярными силами различной природы, а во многих случаях, кроме того, водородными и химическими связями. Она является причиной существования веществ в конденсированном – твёрдом или жидком - состоянии. В газах когезия незначительна; наиболее она выражена в твёрдых телах. Когезия характеризует прочность гомогенного тела по отношению к разрыву и другим деформациям. Преодоление сил когезии при разъединении тела на части требует совершения работы, называемой работой когезии wc. При этом подразумевается, что исследуемое тело не имеет дефектов структуры, например, трещин.
В случае легкоподвижных жидкостей обратимая работа когезии равна удвоенному значению поверхностного натяжения жидкости на границе с воздухом:
 .
.
Это обстоятельство лежит в основе различных методов определения поверхностного натяжения жидкостей, например, метода отрыва кольца, метода отрыва капли (сталагмометрического), метода продавливания сквозь жидкость пузырьков воздуха.
Адгезия
Сцепление приведённых в контакт разнородных твёрдых или жидких тел (фаз) называется адгезией (от лат. adhaesium - прилипание). Подобно когезии, адгезия может быть обусловлена как межмолекулярным взаимодействием, так и химическими связями, в том числе ионной и металлической. Адгезия обусловливает возникновение между двумя телами соединения определённой прочности (прилипание). В этом смысле когезию можно рассматривать как частный случай адгезии при соприкосновении двух однородных тел. Величиной, характеризующей удельное усилие разрушения адгезионного контакта является адгезионная прочность, используемая в технике для оценки свойств клеев, лакокрасочных покрытий и др. В фармации адгезионной прочностью могут быть охарактеризованы, например, способность пластыря, мази или горчичника удерживаться на коже, прочность таблеток, спрессованных из различных порошков, прочность связи оболочек с таблетками и т. п. Количественно адгезионная прочность может быть охарактеризована работой адгезионного отрыва wa.
|
|
При длительном контакте разнородных тел (фаз) может происходить взаимная диффузиявеществ, что приводит к размытию адгезионного шва и к увеличению адгезионной прочности.
Смачивание. Растекание
В случае одновременного контакта между твёрдой, жидкой и газовой фазами адгезия неразрывно связана со смачиванием. В качестве газовой фазы чаще всего выступает воздух.
При нанесении небольшой капли жидкости на поверхность твёрдого тела (или другой, более плотной жидкости) можно в зависимости от природы контактирующих фаз наблюдать различные явления. В одних случаях капля растекается по поверхности с образованием очень тонкого, практически плоского слоя (растекание). Растекание обычно наблюдается при соприкосновении веществ с близкой полярностью, например, вода растекается по поверхности стекла или кварца (полярные жидкость и твёрдое тело), бензол – по поверхности воска или парафина (неполярные жидкость и твёрдое тело). Но многие неполярные жидкости, такие, как нефть, минеральные масла, бензин и т. п. могут растекаться по практически любым твёрдым (металлы, дерево, стекло, пластмассы и др.) или жидким (вода) поверхностям независимо от их полярности. Такое растекание объясняется слабым межмолекулярным взаимодействием и, как следствие, низким поверхностным натяжением жидкости.
|
|
При отсутствии сродства между жидкостью и твёрдой поверхностью наблюдается полное или практически полное несмачивание, когда маленькие капли жидкости принимают почти сферическую форму. Примером полного несмачивания может служить поведение капель ртути на поверхности большинства твёрдых тел (исключая хорошо амальгамирующиеся металлы).
Кроме полного смачивания или несмачивания возможны многочисленные случаи неполного смачивания, когда капля нанесённой жидкости при установившемся равновесии принимает на поверхности твёрдого тела определённую форму (рис. 2.1).
 |
Рис. 2.1. Взаимодействие сил, определяющих форму капли
на твёрдой поверхности
В такой системе имеются три различных поверхности раздела фаз: между твёрдым телом и жидкостью (т - ж), твёрдым телом и газом (т - г) и между жидкостью и газом (ж - г) с поверхностными натяжениями sтж, sтг и sжг соответственно.
Линия, в которой пересекаются все три поверхности раздела, называется контуром смачивания. Угол между плоскостью смачиваемой поверхности и плоскостью, касательной к поверхности жидкости в одной из точек контура смачивания, называется краевым углом смачивания q. Краевой угол всегда измеряется со стороны жидкости. На каждую точку контура смачивания действуют три силы: sтг, стремящаяся растянуть каплю по поверхности (т. е. уменьшить площадь поверхности «т - г»), sтж и sжг, стремящиеся сжать каплю (т. е. уменьшить площадь поверхностей «т - ж» и «ж – г»). Равновесное значение q связано со значением поверхностного натяжения на всех трёх межфазных поверхностях уравнением Т. Юнга:
 ,
,
вытекающим из общего условия равновесия трёх сил:
 .
.
Из уравнения Юнга видно, что сos q является количественной мерой смачивания. А именно: условие сos q = 1 (q = 0о) отвечает полному смачиванию или растеканию, условие 1 > сos q > 0 (0 о < q < 90о, т. е. краевой угол острый) - неполному смачиванию. При плохом смачивании или полном несмачивании поверхности данной жидкостью краевой угол является тупым (q > 90о; cos q < 0).
Косинус краевого угла смачивания, кроме того, является и мерой работы адгезионного отрыва wa:
 .
.
|
|
Соотношение wa и работы когезии для жидкости wк определяет величину краевого угла, а именно: при wa < wкq > 0 о причём с увеличением отношения wa / wк смачивание поверхности улучшается.
Поверхности, хорошо смачивающиеся данной жидкостью, являются по отношению к ней лиофильными (в случае воды – гидрофильными), плохо смачивающиеся – лиофобными (соответственно г идрофобными). Так как гидрофобные вещества обычно хорошо смачиваются маслами, их можно назвать также олеофильными. Гидрофильны, например, желатин, крахмал, глины, стекло; олеофильны - парафин, сажа. Кожа человека почти в одинаковой степени смачивается и водой, и маслами, что существенно при высвобождении и всасывании лекарственных веществ из линиментов, мазей, пластырей, примочек и т. п.
В процессе смачивания жидкостью твёрдой или жидкой поверхности выделяется теплота, называемая теплотой смачивания DHсм. (Правильнее эту величину следовало бы называть теплотой адгезии, так как она обусловлена только взаимодействием конденсированных фаз). В большинстве случаев теплота смачивания имеет значения от 0,4 до 40 кДж/м2. Чем больше теплота смачивания твёрдого тела данной жидкостью, тем лучше смачивание. Таким образом, теплота смачивания, как и краевой угол, может служить количественной характеристикой лиофильности твёрдых поверхностей. Для сравнения гидрофильности различных поверхностей часто используется так называемый коэффициент гидрофильности Kгидр, представляющий собой отношение теплот смачивания данной поверхности водой и бензолом:
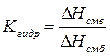
Для гидрофильных веществ Кгидр > 1 для гидрофобных - Кгидр < 1.
Смачивание играет существенную роль во многих технологических и биологических процессах. Так, хорошее смачивание необходимо при нанесении на кожу мазей и линиментов, при стирке и крашении тканей, обработке фотографических материалов, нанесении лакокрасочных покрытий. Смачивание порошков из лекарственных веществ водой (или растворами ПАВ) является одной из важнейших характеристик в технологии лекарств. Избирательное смачиваниеразличных минералов водой или маслами лежит в основе флотации – одного из главных способов обогащения полезных ископаемых, т. е. отделения их от вмещающей горной породы.
|
|
Инверсия смачивания
При различных химических и физических воздействиях лиофильность поверхности может быть изменена, вплоть до замены гидрофильности на гидрофобность и наоборот (инверсия смачивания). На практике инверсия смачивания чаще всего осуществляется с помощью модифицирования твёрдой поверхности с помощью поверхностно-активных веществ. Такая модификация производится погружением твёрдого тела в раствор с достаточно высокой для достижения предельной адсорбции (см. ниже) концентрацией соответствующего ПАВ. При этом молекулы ПАВ адсорбируются на поверхности плотным слоем, что изменяет её свойства. Так, адсорбируясь на гидрофобной поверхности, молекулы ПАВ ориентируются неполярными частями в сторону твёрдого тела, а полярными – в сторону окружающей среды. Если адсорбционное связывание ПАВ с поверхностью достаточно прочное, то адсорбционный слой сохраняется на поверхности и после высушивания. При этом с внешней средой контактирует новая поверхность, образованная полярными группами (рис. 2.2 а), и твёрдое тело становится гидрофильным (происходит гидрофилизация поверхности). В случае адсорбции на гидрофильном теле молекулы ПАВ ориентируются противоположным образом, и происходит гидрофобизация поверхности (рис. 2.2 б).
 |
а б
Рис. 2.2. Ориентация молекул поверхностно-активных веществ
при адсорбции на гидрофобной (а) и гидрофильной (б) твёрдой поверхности
С помощью инверсии смачивания направленно регулируют лиофильность и лиофобность твёрдых тел при флотации, при пропитке тканей с целью придания непромокаемости одежде. Следует, однако, помнить, что такая пропитка тканей действует лишь ограниченное время, потому что ПАВ в силу своей дифильности растворяются в дождевой воде, и со временем ткань теряет водоотталкивающие свойства. Возможно частичное изменение гидрофильности кожи для улучшения всасывания лекарственных веществ, например, из мазей при добавлении определённых ПАВ в состав этих мазей.
ГЛАВА 3
АДСОРБЦИЯ
Общие понятия
Адсорбция - это самопроизвольное концентрирование вещества из объёма фаз (обычно имеются в виду жидкие и газовые фазы) на поверхности раздела между ними. Вещество, способное к адсорбции на данной поверхности раздела, называется адсорбтивом. Когда речь идёт об адсорбтиве, уже находящемся на поверхности раздела (адсорбированном), то его чаще называют адсорбатом. Вещество (чаще всего твёрдое или, по крайней мере, более плотное), на поверхности которого происходит адсорбция, называется адсорбентом. Будучи самопроизвольным процессом, адсорбция сопровождается выделением теплоты (теплота адсорбции).
|
|
Различают физическую и химическую адсорбцию (хемосорбцию). Физическая адсорбция может быть обусловлена силами различной природы - ван-дер-ваальсовыми (электростатическими, дисперсионными). Её теплота обычно невелика и соизмерима с теплотой смачивания. Проявление дисперсионных сил наиболее универсально, так как они приблизительно одинаковы для взаимодействующих веществ любой природы. Дисперсионные силы обусловливают так называемую неспецифическую адсорбцию, не зависящую от природы адсорбента или адсорбата. Если же физическая адсорбция обусловлена электростатическими силами – взаимодействием между ионами, диполями, квадруполями, - она зависит от природы адсорбата и называется специфической. Из-за небольшой прочности связей, образующихся между адсорбатом и адсорбентом, физическая адсорбция обратима. Хемосорбция сопровождается образованием химических связей, так что адсорбционный слой при этом можно рассматривать как поверхностное химическое соединение. Хемосорбция необратима и для неё характерны большие тепловые эффекты (десятки и сотни кДж/моль).
Физическая адсорбция – процесс обратимый. Адсорбированные молекулы через какое-то время могут покинуть поверхность адсорбента. Явление, обратное адсорбции, называется десорбцией. Десорбция ускоряется при повышении температуры, уменьшении давления, а также при вытеснении адсорбата с поверхности другими веществами, более способными к адсорбции в данных условиях. Адсорбция и десорбция идут в системе непрерывно. При равенстве скоростей адсорбции и десорбции выступает адсорбционное равновесие, которому соответствует равновесная концентрация адсорбтива в раствореили равновесное давление его в газовой фазе. Равновесие «адсорбция Û десорбция» смещается влево при понижении температуры и увеличении концентрации (давления) адсорбтива в жидкой или газовой фазе.
Значительную роль при адсорбции играет строение поверхности раздела, т. е. на адсорбенте одной и той же природы адсорбция протекает различно при гладкой («открытой») и искривлённой (шероховатой, пористой и т. п.) конфигурации поверхности.
Количественно адсорбция характеризуется двумя величинами: 1) поверхностным избытком Г, (или, иначе, гиббсовской адсорбцией) представляющим собой разность концентраций адсорбата в поверхностном слое и в объёме фазы (чаще всего раствора) и 2) величиной адсорбции А (или просто адсорбцией, которая определяется количеством х адсорбата (моль или кг), поглощённым единицей массы m, объёма V или площади поверхности S адсорбента:



Размерность А в системе СИ в соответствии с этими уравнениями будет выражаться в моль/кг (кг/кг), моль/м3 (кг/м3) и моль/м2 (кг/м2); размерность Г – моль/м2. Но, поскольку обе эти величины обычно очень малы, допускается использование в числителе кратных единиц, например, ммоль, г, мг, и т. п.
При малых концентрациях адсорбтива и, соответственно, при малых величинах адсорбции значения Г и А близки друг к другу.
Зависимость равновесной адсорбции (поверхностного избытка) от равновесной концентрации (давления) при постоянной температуре называется изотермой адсорбции (рис. 3.1). В общем случае она имеет вид сложной кривой с тремя различными по характеру участками:
 |
Рис. 3.1. Изотерма адсорбции
Первый участок, 0 а, является линейным. Он соответствует очень малым равновесным концентрациям, когда адсорбатом занимается лишь очень малая часть поверхности. При таких очень малых заполнениях поверхности адсорбция может быть описана уравнением У. Генри:
 или
или  ,
,
где К - коэффициент Генри
Второй участок, аб, нелинейный, соответствующий равновесным концентрациям (давлениям), при которых адсорбат покрывает уже значительную часть поверхности. Третий участок, бв, линейный и параллельный оси абсцисс, соответствует большим равновесным концентрациям (давлениям), при которых вся поверхность полностью занята адсорбатом и дальнейшее повышение концентрации (давления) уже не сказывается на величине адсорбции. Величина адсорбции (поверхностного избытка), наблюдаемая при этом, называется предельной или максимальной адсорбцией и обозначается А¥ или Амакс. Принято также говорить о предельном (максимальном) поверхностном избытке Г¥ (или Гмакс).
Так как величина адсорбции зависит, кроме концентрации или давления адсорбтива, ещё и от температуры, возможно графическое отображение и этой зависимости. Так, зависимость А или Г от температуры при постоянной концентрации (или постоянном давлении) называется изопикной (или, соответственно, изобарой) адсорбции. В некоторых случаях требуется также знание зависимости равновесной концентрации (или давления) от температуры при постоянной величине адсорбции. Такая графическая зависимость называется изостерой адсорбции.
Механизм адсорбции зависит от природы фаз, на границе между которыми она происходит. Поэтому принято различать виды адсорбции на поверхностях раздела «жидкость – газ» (ж – г), «жидкость – жидкость» (ж – ж), «твёрдое тело – газ» (т – г) и «твёрдое тело – жидкость» (т – ж). Следует помнить, что под «жидкостью» во всех случаях подразумеваются растворы адсорбирующихся веществ, а под «газом» - смеси газов или паров.
3.2. Адсорбция на поверхности раздела “жидкость - газ”
Чаще всего в роли газовой фазы выступает воздух. Поверхность раздела раствора адсорбтива с воздухом является гладкой и равноценной в энергетическом отношении. Поэтому все точки такой поверхности раздела являются равнодоступными для молекул адсорбтива. Кроме того, на поверхности жидкости протекает только физическая адсорбция, не осложнённая возникновением поверхностных химических соединений. Это делает данный вид адсорбции наиболее удобным для теоретического рассмотрения.
В 1876 г. Дж. Гиббс вывел фундаментальное уравнение, описывающее адсорбцию поверхностно-активных веществ:
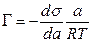
где Г - величина поверхностного избытка ПАВ при его активности в растворе, равной а; ds/d a – поверхностная активность, т. е. производная, показывающая, как изменяется поверхностное натяжение раствора с ростом термодинамической активности ПАВ; Т - температура; R - универсальная газовая постоянная.
В случае очень разбавленных растворов, когда активность практически равна концентрации растворённого вещества С, уравнение Гиббса может иметь такой вид:
 .
.
Из уравнения Гиббса следует, что поверхностный избыток (гиббсовская адсорбция) тесно связан с поверхностной активностью адсорбтива. А именно, значение Г будет тем больше, чем больше его поверхностная активность. Знак «минус» требуется для того, чтобы согласовать знак адсорбции и производной ds/dC. Если растворённое вещество вызывает уменьшение поверхностного натяжения, т. е. является поверхностно-активным, производная будет отрицательной, и, следовательно, значение Г будет положительным. Таким образом, из уравнения Гиббса следует, что в случае присутствия в растворе ПАВ, оно всегда будет в той или иной степени адсорбироваться на поверхности.
Имеются вещества, для которых производная ds/dC положительна, то есть растворение их приводит к увеличению поверхностного натяжения. Такие вещества называются поверхностно-инактивными. Согласно уравнению Гиббса для их растворов Г должна быть отрицательной. Обычно такая «отрицательная» адсорбция трактуется как уход, «выталкивание» молекул поверхностно-инактивных веществ из поверхностного слоя в объём раствора. Объяснить это явление можно таким образом. Обычно поверхностно-инактивными по отношению к воде являются ионные соединения - сильные электролиты, например, неорганические кислоты, соли, основания и т. п. Ионы этих соединений окружены объёмной гидратной оболочкой, которая по сравнению с обычной водой обладает рядом специфических свойств, в том числе повышенными плотностью, вязкостью, поверхностным натяжением. Поэтому при подходе гидратированных ионов к поверхности раствора в слое, непосредственно граничащем с воздухом, кроме молекул воды находится и значительное число верхних частей гидратных оболочек, что соответствующим образом изменяет свойства поверхностного слоя. Сами же ионы, лежащие под гидратной оболочкой, можно рассматривать как «вытесненные» с поверхности раздела.
Наконец, есть вещества, для которых ds/dC = 0, то есть они своим присутствием не изменяют поверхностного натяжения раствора (при малых концентрациях). Эти вещества, как, например, низшие углеводы, называются поверхностно-неактивными. Адсорбция их на поверхности водного раствора отсутствует.
Для того, чтобы уравнение Гиббса было удобно применять при практических расчётах, его интегрируют, после чего оно приобретает вид
 ,
,
где Ds - изменение поверхностного натяжения раствора по сравнению с чистым растворителем, а DС – изменение молярной концентрации исследуемого ПАВ.
При адсорбции ПАВ их молекулы в поверхностном слое приобретают определённую ориентацию. А именно: гидратированные полярные группы погружены в раствор, а неполярные углеводородные радикалы выталкиваются в воздух (рис. 3.2).
 |
При этом ориентация углеводородных радикалов зависит ещё и от концентрации ПАВ в растворе, точнее от значения их гиббсовской адсорбции. Так, при очень малых концентрациях значение Г тоже очень малó, т. е. молекулы ПАВ занимают незначительную долю поверхности раздела. Из-за теплового движения они могут свободно перемещаться по поверхности, образуя подобие «двухмерного газа». Углеводородные радикалы при этом могут располагаться в газовой фазе совершенно произвольным образом (рис. 3.2, а), а если они достаточно длинны, то могут в добавок к этому изменять свою конформацию из-за свободного вращения сегментов вокруг s-связей.
При средних концентрациях, когда молекулы адсорбата занимают уже значительную долю поверхности, они при столкновениях могут соединяться друг с другом в более или менее долго живущие ассоциаты (рис. 3.2, б). Эти ассоциаты могут включать в себя различное число молекул ПАВ, которое становится тем бóльшим, чем больше концентрация ПАВ в растворе. Образование таких ассоциатов в какой-то мере напоминает конденсацию пара в двухмерную жидкость.
Наконец, при очень больших концентрациях молекулы поверхностно-активного адсорбата могут занять всю поверхность раздела и образовать на ней плотный адсорбционный слой (рис. 3.2, в). При этом они образуют упорядоченную кристаллоподобную структуру. Схематическое изображение такой структуры в разрезе напоминает частокол и было названо в честь одного из выдающихся исследователей явления адсорбции – И. Лэнгмюра «частоколом Лэнгмюра).
И. Лэнгмюр, в частности, сконструировал прибор (т. н. весы Лэнгмюра), с помощью которого можно получать плотный адсорбционный слой на поверхности раствора с определённой площадью поверхности. Измеряя давление, необходимое для разрушения такого слоя, можно вычислить значение межмолекулярных сил сцепления между молекулами ПАВ. И. Лэнгмюр также предложил один из первых и, вместе с тем, достаточно точный и надёжный метод определения размеров молекул ПАВ исходя из величины гиббсовской адсорбции. Подробнее этот метод описан в руководствах к лабораторным работам по коллоидной химии.
Следует отметить, что при очень больших концентрациях ПАВ уравнение Гиббса неприменимо. Это связано с тем, что при образовании плотного адсорбционного слоя имеет место максимальная адсорбция, и изотерма её, начиная с определённого момента, представляет собой прямую линию, параллельную оси концентраций. Этот горизонтальный участок изотермы не может быть описан уравнением Гиббса, которое является уравнением восходящей кривой.
Одной из главных причин адсорбции на поверхности «ж – г» является малая растворимость ПАВ в воде (или в другой жидкости). Благодаря этому химический потенциал ПАВ в поверхностном слое меньше, чем в объёме раствора, что и приводит к вытеснению их молекул на поверхность раздела. Следует помнить, что адсорбция из растворов ПАВ идёт не только на поверхности, граничащей с воздухом, но и на стенках сосуда. После того, как все поверхности, ограничивающие раствор, будут полностью заняты адсорбатом, при больших концентрациях ПАВ их молекулы начнут вытесняться в объём раствора, формируя новые поверхности раздела и образуя так называемые мицеллы ПАВ (см. п. 1.8)
Примером применения адсорбции ПАВ на поверхности раздела «ж – г» является стабилизация мыльных, флотационных пожаротушащих и косметических пен; в фармации она используется при получении и стабилизации лекарственных пен - кислородных коктейлей, а также средств, применяемых при лечении ожогов или заживлении ран. Этот вид адсорбции лежит в основе одного из широко распространённых методов исследования и анализа – газожидкостной хроматографии.
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!