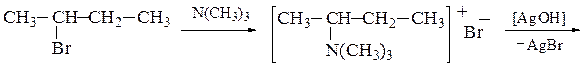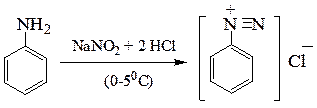Амины можно рассматривать как органические производные аммиака.
1). По количеству замещенных атомов водорода в молекуле аммиака на углеводородные радикалы амины подразделяют на первичные (R–NH2), вторичные (R–NH–R΄) и третичные  .
.
΄

изобутиламин метилизопропиламин диметилэтиламин
(первичный) (вторичный) (третичный)
2) По природе радикала: алифатические, карбо- и гетероциклические – предельные и непредельные, а также ароматические.
3) По количеству аминогрупп: моноамино-, диамино- и др. соединения. (Вещества, содержащие при одном углеродном атоме более одной аминогруппы нестабильны).
Номенклатура. Название наиболее простых аминов образуется от названий алкильных групп, связанных с атомом азота, к которому добавляется слово «амин», например: CH3–NH2 – метиламин, (СH3)2CHCH2–NH2 – изобутиламин. Вторичные и третичные амины с одинаковыми радикалами называют исходя из названия и количества радикалов: (CH3)3N –триметиламин (CH3CH2)2NH – диэтиламин. Если радикалы различны, то перечисляют радикалы по старшинству, добавляя слово «амин»:CH3–NH–CH(CH3)2 – метилизопропиламин.
По номенклатуре IUPAC за основу названия берут название соответствующего углеводорода, а аминогруппу обозначают приставкой: H2N–CH2CH2CH2CH2CH2CH2–NH2 – 1,6-диаминогексан (гексаметилендиамин).
Получение.
1. Методы алкилирования аммиака (или аминов).
а) Аммонолиз и аминолиз алкилгалогенидов.




Реакция приводит к смеси первичного, вторичного, третичного аминов и четвертичной аммониевой соли. Аналогичный результат дает алкилирование аммиака и аминов спиртами, однако эта реакция идет только при 300 0C в присутствии катализатора Al2O3.
б) Первичные амины синтезируют алкилированием фталимида в присутствии основания по методу Габриэля:


Гидролиз N-фталимидных производных осуществляется нагреванием со щелочами, кислотами или лучше всего с гидразин-гидратом.
2. Восстановление других азотсодержащих функциональных органических соединений – альдиминов (кетиминов), оксимов, оснований Шиффа, нитрилов, амидов карбоновых кислот, нитросоединений и т.д.:

3. Перегруппировка амидов карбоновых кислот по Гофману:

4. Декарбоксилирование α-аминокислот имеет малое значение для химии, но широко распространено в биологических объектах.
При декарбоксилировании a-аминокислот образуются биогенные амины, выполняющие в организме важные биологические функции

Физические свойства. Метиламин, диметиламин, триметиламин и этиламин в обычных условиях – газы, следующие члены гомологического ряда – жидкости, с закономерно возрастающими температурами кипения. Низшие амины имеют неприятный запах, высшие запаха не имеют. Первичные и вторичные амины ассоциированы за счет образования водородных связей.

Ассоциация приводит к заметному повышению температур кипения по сравнению с соединениями с той же молекулярной массой, но не образующими водородных связей. Хорошая растворимость в воде низших аминов обусловлена образованием водородных связей с молекулами воде; по мере увеличения радикала их растворимость в воде резко уменьшается.
Химические свойства
1. Основность аминов обусловлена способностью атомов азота присоединять протон к неподеленной паре электронов с образованием катионов аммонийного типа. Основность аминов измеряется константой равновесия реакции гидратации:

Основность амина тем выше, чем больше электронная плотность сосредоточена на атоме азота. Благодаря +I-эффекту алкильной группы алифатические амины (особенно третичные) имеют большую электронную плотность на атоме N, чем аммиак, и следовательно, большую основность.
Таблица 19. Зависимость константы основности от типа амина
|
|
NH3
|
CH3NH2
|
C2H5NH2
|
(C2H5)2NH
|

|
|
К в
|
1,8 ·10-5
|
4,4 ·10-4
|
4,7 ·10-4
|
9,5 ·10-4
|
1,6 ·10-3
|
Таблица 20. Физические свойства аминов
|
Название
|
формула
|
Т.пл. / Т.кип. (0 С)
|
К в
|
|
Метиламин
Диметиламин
Триметиламин
Этиламин
Диэтиламин
Триэтиламин
Пропиламин
Дипропиламин
Трипропиламин
Изо пропиламин
Бутиламин
Изо бутиламин
Втор бутиламин
трет бутиламин
Циклогексиламин
Бензиламин
α-Фенилэтиламин
β-Фенилэтиламин
Тетраметилендиамин
Гексаметилендиамин
Анилин
N-Метиланилин
N,N-Диметиланилин
Дифениламин
Трифениламин
о -толуидин
м -толуидин
п -толуидин
о -анизидин
м -анизидин
п -анизидин
о- нитроанилин
м -нитроанилин
п -нитроанилин
2,4-динитроанилин
2,4,6-тринитроанилин
о -фенилендиамин
м -фенилендиамин
п фенилендиамин
Бензидин
|
CH3NH2
(CH3)2NH
(CH3)3N
CH3CH2NH2
(CH3CH2)2NH
(CH3CH2)3N
CH3CH2CH2NH2
(CH3CH2CH2)2NH
(CH3CH2CH2)3N
(CH3)2CHNH2
CH3(CH2)3NH2
(CH3)2CHCH2NH2
CH3CH2CH(CH3)NH2
(CH3)3CNH2
С6H11NH2
С6H5CH2NH2
С6H5CH(CH3)NH2
С6H5CH2CH2NH2
H2N(CH2)4NH2
H2N(CH2)6NH2
С6H5NH2
С6H5NHСН3
С6H5N(СН3)2
(С6H5)2NH
(С6H5)3N
o- СН3С6Н4NН2
м- СН3С6Н4NН2
п- СН3С6Н4NН2
o- СН3ОС6Н4NН2
м- СН3ОС6Н4NН2
п- СН3ОС6Н4NН2
o- NО2С6Н4NН2
м- NО2С6Н4NН2
п- NO2С6Н4NН2
2,4-(NO2)2С6Н3NН2
2,4,6-(NO2)3С6Н2NН2
o- С6Н4(NН2)2
м- С6Н4(NН2)2
п- С6Н4(NН2)2
п -NН2С6Н4С6Н4NН2 -п
|
- 92 / - 7,5
- 96 / 7,5
- 117 / 3
- 80 / 17
- 39 / 55
- 115 / 89
- 83 / 49
- 63 / 110
- 93 / 157
- 101 / 34
- 50 / 78
- 85 / 68
- 104 / 63
─ / 134
- 67 / 4
─ / 185
─ / 187
/ / 195
8 / 117
39 / 196
- 6 / 184
- 57 / 196
3 / 194
53 / 302
127 / 365
- 28 / 200
- 30 / 203
44 / 200
5 / 225
─ / 251
57 / 244
71 / 284
114 / 307 (разл.)
148 / 332
187 / ─
188 / ─
104 / 251
63 / 287
142 / 267
127 / 401
|
4,4 . 10 -4
5,1 . 10 -4
0,6 . 10 -4
4,7 . 10 -4
9,5 . 10 -4
5,5 . 10 -4
3,8 . 10 -4
8,1 . 10 -4
4,5 . 10 -4
4,1 . 10 -4
0,23 . 10 -4
4,2 . 10 -10
7,1 . 10 -10
11 . 10 -10
0,7 . 10 -10
2,5 . 10 -10
4,9 . 10 -10
12 . 10 -10
3 . 10 -10
2 . 10 -10
15 . 10 -10
3,5 . 10 -14
3,2 . 10 -12
0,1 . 10 -12
3,3 . 10 -10
7,6 . 10 -10
11 . 10 -10
7,4 . 10 -13
|
Ароматические амины вследствие сопряжения неподеленной пары электронов азота с p-электронным облаком бензольного ядра являются более слабыми основаниями, причем этот эффект усиливается при введении в ароматическое кольцо электроноакцепторных группировок..С увеличением объемов заместителей, окружающих реакционный центр вещества, возрастают пространственные препятствия для его атаки молекулой реагента. Это также относится и к протонированию аминов. В связи с этим амины, содержащие большие радикалы, проявляют более слабые основные свойства по сравнению с ожидаемыми при рассмотрении только электронных эффектов радикалов, окружающих атом азота.
2. Алкилирование аминов.
(C2H5)3N + C6H5CH2Cl ¾® [(C2H5)3NCH2C6H5]+ Cl―
Четвертичные аммониевые соли при взаимодействии с водными растворами щелочей превращаются в гидрооксиды тетраалкиламмония.
Расщепление четвертичных аммониевых оснований по Гофману – схема получения алкенов из галогеналканов против правила Зайцева, например:
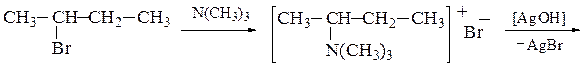

3. Ацилирование первичных и вторичных аминов происходит при реакции ангидридами или галогенангидридами кислот и приводит к N-замещенным амидам кислот:
С6Н5NH2 + (CH3CO)2O ¾® CH3CONHC6H5 + CH3COOH
N-фениламид уксусной
кислоты (ацетанилид)

N-пропиламид уксусной кислоты
4. Реакции аминов с азотистой кислотой.
В зависимости от типа амина обработка азотистой кислотой приводит к различным продуктам реакции.
Первичные алифатические амины при взаимодействии с азотистой кислотой выделяют азот с образованием спиртов или алкенов (с третичными углеводородными радикалами):


Вторичные амины образуют N-нитрозоамины:

N-нитрозометилбутиламин
Третичные амины алифатического ряда не взаимодействуют с НNO2, третичные жирноароматические амины (диалкилфениламины) нитрозируются в пара -положение бензольного кольца:

п- нитрозо-N,N-диметиламинобензол
Первичные ароматические амины образуют соли диазония
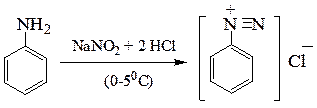
фенилдиазоний хлорид
Механизм реакций аминов с азотистой кислотой выглядит следующим образом:


В случае первичных аминов возникающий катион (I) теряет протон и превращается в диазогидрат, который в кислой среде переходит в соль диазония (II), разлагающуюся с образованием карбкатиона (III) и выделением азота:


Конечными продуктами являются спирты или алкены в зависимости от природы образующегося карбкатиона (III) (третичные карбкатионы легче образуют алкены). Соединения (II), у которых диазониевая группа находится при ароматическом кольце, устойчивы на холоду и могут быть получены взаимодействием первичных ариламинов со смесью нитрита натрия с минеральной кислотой при 0-10 0С. В случае вторичных аминов катион (I) отщепляет протон с образованием N-нитрозоамина:

В случае взаимодействия N,N-диметиламинобензола с азотистой кислотой механизм реакции выглядит следующим образом:





 .
.