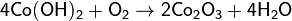Для восполнения дефицита марганца в организме, необходимо включать в рацион следующие продукты:
· более всего марганца содержат крупы: гречка, рис, овсянка, пшено;
· довольно много марганца и в бобовых — больше в фасоли и чуть меньше в горохе;
· в основном марганцем богаты растения, среди которых огородная зелень: петрушка, укроп, шпинат, салат;
· также насыщены марганцем и орехи: фундук, грецкий орех, миндаль, арахис,фисташки.
· из овощей марганец присутствует в свекле, чесноке, среди фруктов им богаты абрикосы;
· чуть меньше марганца содержат грибы: лисички, подберезовики и белый гриб.
Калия перманганат (Kalii permanganas)
Показания:
· инфицированные раны, язвы и ожоги кожи (смазывание язвенных и ожоговых поверхностей);
· инфекционно-воспалительные заболевания слизистой оболочки рта и ротоглотки (в т.ч. ангины) — полоскание полости рта и ротоглотки;
· гинекологические и урологические заболевания (кольпиты и уретриты) — для промывания и спринцеваний;
· отравления, вызванные приемом внутрь алкалоидов (морфин, хинин, аконитин, никотин), синильной кислоты, фосфора, — для промываний желудка
Противопоказания:
· Гиперчувствительность.
Побочные действия:
· Аллергические реакции, при использовании концентрированных растворов — ожоги и раздражение.
Передозировка:
· Симптомы: резкая боль в полости рта, по ходу пищевода, в животе, рвота, диарея; слизистая оболочка полости рта и глотки — отечная, темно-коричневого, фиолетового цвета, возможен отек гортани, развитие механической асфиксии, ожогового шока, двигательного возбуждения, судорог, явлений паркинсонизма, геморрагического колита, нефропатии, гепатопатии. При пониженной кислотности желудочного сока возможно развитие метгемоглобинемии с выраженным цианозом и отдышкой. Смертельная доза для детей — около 3 г, для взрослых 0,3–0,5 г/кг.
· Лечение: назначение метиленового синего (50 мл 1% раствора), аскорбиновой кислоты (в/в — 30 мл 5% раствора), цианокобаламина — до 1 мг, пиридоксина (в/м — 3 мл 5% раствора).
Кобальт
Со, химический элемент с атомным номером 27. Его атомная масса 58,9332. Природный кобальт состоит из двух стабильных нуклидов: 59Со (99,83% по массе) и 57Со (0,17%). В периодической системе элементов Д. И. Менделеева кобальт входит в группу VIII и вместе с железом и никелем образует в 4-м периоде в этой группе триаду близких по свойствам переходных металлов. Конфигурация двух внешних электронных слоев атома кобальта 3s2p6d74s2. Образует соединения чаще всего в степени окисления +2, реже - в степени окисления +3 и очень редко в степенях окисления +1, +4 и +5.
Кобальт - минеральное вещество, который является частью витамина B12. Обычно измеряется в микрограммах (мкг). Кобальт - необходим для красных кровяных клеток. Должен быть получен из пищевых источников. Дневная норма кобальта не установлена, и лишь очень малые количества этого минерального вещества нужны в рационе(обычно не более 8 мкг).
Нахождение в природе.
В земной коре содержание кобальта равно 4·10-3% по массе. Кобальт входит в состав более 30 минералов. К ним относятся каролит CuCo2S4, линнеит Co3S4, кобальтинCoAsS, сферокобальтит CoCO3, смальтит СоAs2 и другие. Как правило, кобальту в природе сопутствуют его соседи по 4-му периоду — никель, железо, медьи марганец. В морской воде приблизительно (1-7)·10-10 % кобальта.
Кобальт — относительно редкий металл, и богатые им месторождения в настоящее время практически исчерпаны. Поэтому кобальтсодержащее сырье (часто это никелевые руды, содержащие кобальт как примесь) сначала обогащают, получают из него концентрат. Далее для извлечения кобальта концентрат или обрабатывают растворами серной кислоты или аммиака, или методами пирометаллургии перерабатывают в сульфидный или металлический сплав. Этот сплав затем выщелачивают серной кислотой. Иногда для извлечения кобальта проводят сернокислотное «кучное» выщелачивание исходной руды (измельченную руду размещают в высоких кучах на специальных бетонных площадках и сверху поливают эти кучи выщелачивающим раствором).
Физические свойства.
Кобальт — твердый металл, существующий в двух модификациях. При температурах от комнатной до 427 °C устойчива α-модификация. При температурах от 427 °C до температуры плавления (1494 °C) устойчива β-модификация кобальта (решётка кубическая гранецентрированная). Кобальт — ферромагнетик, точка Кюри 1121 °C. Желтоватый оттенок ему придает тонкий слой оксидов.
Химические свойства.
Оксиды.
· На воздухе кобальт окисляется при температуре выше 300 °C.
· Устойчивый при комнатной температуре оксид кобальта представляет собой сложный оксид Co3O4, имеющий структуру шпинели, в кристаллической структуре которого одна часть узлов занята ионами Co2+, а другая — ионами Co3+; разлагается с образованием CoO выше 900 °C.
· При высоких температурах можно получить α-форму или β-форму оксида CoO.
· Все оксиды кобальта восстанавливаются водородом:

Оксид кобальта (III) можно получить, прокаливая соединения кобальта (II), например:
Другие соединения.
· При нагревании, кобальт реагирует с галогенами, причём соединения кобальта (III) образуются только с фтором.


· С серой кобальт образует 2 различных модификации CoS. Серебристо-серую α-форму (при сплавлении порошков) и чёрную β-форму (выпадает в осадок из растворов).
· При нагревании CoS в атмосфере сероводорода получается сложный сульфид Со9S8
· С другими окисляющими элементами, такими как углерод, фосфор, азот, селен, кремний, бор. кобальт тоже образует сложные соединения, являющиеся смесями где присутствует кобальт со степенями окисления 1, 2, 3.
· Кобальт способен растворять водород, не образуя химических соединений. Косвенным путем синтезированы два стехиометрических гидрида кобальта СоН2 и СоН.
· Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску. Растворы солей кобальта в спиртах темно-синие. Многие соли кобальта нерастворимы.
· Кобальт создаёт комплексные соединения. Чаще всего на основе аммиака.
Наиболее устойчивыми комплексами являются лутеосоли [Co(NH3)6]3+ жёлтого цвета и розеосоли [Co(NH3)5H2O]3+ красного или розового цвета.
· Также кобальт создаёт комплексы на основе CN−, NO2− и многих других.
На воздухе компактный кобальт устойчив, при нагревании выше 300 °C покрывается оксидной пленкой (высокодисперсный кобальт пирофорен). С парами воды, содержащимися в воздухе, водой, растворами щелочей и карбоновых кислот кобальт не взаимодействует. Концентрированная азотная кислота пассивирует поверхность кобальта, как пассивирует она и поверхность железа.
В электрохимическом ряду напряжений металлов кобальт расположен между железом и никелем. Он взаимодействует почти со всеми другими элементами. Так, при нагревании кобальт легко соединяется с галогенами, образуя галогениды. При действии фтора на порошок кобальта или СоСl2 кобальт может восстановиться до 3-валентного и образовать коричневый фторид СоF3. Также при нагревании кобальт взаимодействует с серой, селеном, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, причем проявляет валентность от +1 до +6. Сульфиды кобальта образуются в результате взаимодействия свеже-восстановленного кобальтового порошка с Н2S. При 400 °С образуется Со3S4, а при 700 °С - СоS. Сульфид образуется и при взаимодействии кобальта с сернистым ангидридом при 800 °С.
В разбавленных соляной и серной кислотах кобальт медленно растворяется с выделением водорода и образованием хлорида СоСl2 или сульфата СоSO4. Разбавленная азотная кислота растворяет кобальт с выделением оксидов азота и образованием нитрата Со(NO3)2. Концентрированная азотная кислота пассивирует кобальт. Все соли кобальта хорошо растворимы в воде. Едкие щелочи осаждают из водных растворов солей синий гидроксид Со(ОН)2.
Известно несколько оксидов кобальта. Оксид кобальта(II) СоО обладает основными свойствами. Он существует в двух полиморфных модификациях: a -форма (кубическая решетка), устойчивая при температурах от комнатной до 985°C, и существующая при высоких температурах b -форма (также кубическая решетка). СоО можно получить или нагреванием в инертной атмосфере гидроксоркарбоната кобальта Со(ОН)2СоСО3, или осторожным восстановлением Со3О4.
Если нитрат кобальта Со(NO3)2, его гидроксид Со(ОН)2 или гидроксокарбонат прокалить на воздухе при температуре около 700°C, то образуется оксид кобальта Со3О4 (CoO·Co2O3). Этот оксид по химическому поведению похож на Fe3О4. Оба эти оксида сравнительно легко восстанавливаются водородом до свободных металлов:
Со3О4 + 4Н2 = 3Со + 4Н2О.
При прокаливании Со(NO3)2, Со(ОН)2 и т. д. при 300°C возникает еще один оксид кобальта — Со2О3. При приливании раствора щелочи к раствору соли кобальта(II) выпадает осадок Со(ОН)2, который легко окисляется. Так, при нагревании на воздухе при температуре немногим выше 100°C Со(ОН)2 превращается в СоООН.
Если на водные растворы солей двухвалентного кобальта действовать щелочью в присутствии сильных окислителей, то образуется Со(ОН)3.
При нагревании кобальт реагирует со фтором с образованием трифторида СоF3. Если на СоО или СоСО3 действовать газообразным HF, то образуется еще один фторид кобальта СоF2. При нагревании кобальт взаимодействует с хлором и бромом с образованием, соответственно, дихлорида СоСl2 и дибромида СоBr2. За счет реакции металлического кобальта с газообразным НI при температурах 400-500°C можно получить дииодид кобальта СоI2.
Сплавлением порошков кобальта и серы можно приготовить серебристо-серый сульфид кобальта СоS (b-модификация). Если же через раствор соли кобальта(II) пропускать ток сероводорода H2S, то выпадает черный осадок сульфида кобальта СоS (a-модификация):
CoSO4 + H2S = CoS + H2SO4
Известны растворимые в воде соли кобальта — сульфат СоSO4, хлорид СоСl2, нитрат Со(NO3)2 и другие. Интересно, что разбавленные водные растворы этих солей имеют бледно-розовую окраску. Если же перечисленные соли (в виде соответствующих кристаллогидратов) растворить в спирте или ацетоне, то возникают темно-синие растворы. При добавлении воды к этим растворам их окраска мгновенно переходит в бледно-розовую.
К нерастворимым соединениям кобальта относятся фосфат Со3(PO4)2, силикат Со2SiO4 и многие другие. Для кобальта, как и для никеля, характерно образование комплексных соединений. Так, в качестве лигандов при образовании комплексов с кобальтом часто выступают молекулы аммиака NH3. При действии аммиака на растворы солей кобальта(II) возникают амминные комплексы кобальта красного или розового цвета, содержащие катионы состава [Co(NH3)6-n(H2O)n]2+. Эти комплексы довольно неустойчивы и легко разлагаются даже водой.
Значительно стабильнее амминные комплексы трехвалентного кобальта, которые можно получить действием аммиака на растворы солей кобальта в присутствии окислителей. Так, известны гексамминные комплексы с катионом [Co(NH3)6]3+ (эти комплексы желтого или коричневого цвета получили название лутеосолей), аквапентамминные комплексы красного или розового цвета с катионом [Co(NH3)5H2O]3+ (так называемые розеосоли) и др. В ряде случаев лиганды вокруг атома кобальта могут иметь различное пространственное расположение, и тогда существуют цис- и транс-изомеры соответствующих комплексов. В качестве лигандов в комплексах кобальта могут выступать также анионы CN-, NO2- и другие.
При взаимодействии смеси водорода и СО с гидроксокарбонатом кобальта при повышенном давлении, а также взаимодействием под давлением СО и порошка металлического кобальта получают биядерный октакарбонил дикобальта состава Со2(СО)8. При его осторожном нагревании образуется карбонил Со4(СО)12. Карбонил Со2(СО)8 используют для получения высокодисперсного кобальта, применяемого для нанесения кобальтовых покрытий на различные материалы.
Биологическое действие.
Кобальт - минеральное вещество, который является частью витамина B12. Обычно измеряется в микрограммах (мкг). Кобальт - необходим для красных кровяных клеток. Должен быть получен из пищевых источников. Суточная потребность: 40-70 мкг. Накапливается в крови, селезенке, костной ткани, яичниках, гипофизе, печени. Содержится в молоке, хлебе и хлебобулочных изделиях, печени, овощах, бобовых.
Выяснена основная роль солей кобальта для живого организма – они участвуют в синтезе витамина B12. В последние годы этот витамин стал привычным в медицинской практике лечебным средством, которое вводят в мышцы больного, в чьем организме по той или иной причине не хватает кобальта.
Участие кобальт принимает во многих процессах организма. Этот элемент активирует процесс кроветворения – костный мозг вырабатывает эритроциты, он помогает лучше усваивать железо, потому постоянно поддерживается нормальный состав крови. В кобальте нуждается и микрофлора кишечника, которая «ответственна» за всасывание железа. Кобальт фактически является питанием для бактерий в кишечнике и при нехватке этого элемента, возможно развитие разных видов анемий. При нехватке кобальта не может нормально протекать и процесс кровообращения.
Кобальт способен снять раздражительность и утомление, отрегулировать работу нервной системы, предотвратить обострение нервных болезней, защитить от повреждений нервные клетки (элемент присутствует в клеточных миелиновых оболочках).
Кобальт также участвует в обменных процессах, что активирует выработку ферментов и способствует нормализации деятельности эндокринной системы. Участвует кобальт также в процессе синтеза углеводов, белков и жиров. А при взаимодействии с иными веществами, он участвует в синтезе ДНК и РНК и способен провоцировать процесс обновления клеток организма.
Достаточное наличие кобальта в организме важно, поскольку это позволяет сохранять и нормально развивать костную ткань. Потому продукты, содержащие кобальт, обязательно должны быть в рационе пожилых людей, женщин и детей.
Здоровое состояние сосудов также во многом зависит от кобальта. Элемент препятствует развитию атеросклероза, поскольку уменьшает в крови количество «плохого» холестерина, а также способствует его выведению из организма – так он не успевает откладываться в сосудах.
Обладает кобальт также иммуностимулирующим свойством, что позволяет увеличивать фагоцитарную активность лейкоцитов. Другими словами, лейкоциты начинают активнее связывать, поглощать и переваривать болезнетворные микроорганизмы, которые попадают в организм. При нехватке кобальта в организме не может нормально работать и поджелудочная железа.
При взаимодействии с другими веществами кобальт способствует сохранению молодости. Так кобальт, марганец и медь ускоряют выздоровление после перенесенных тяжелых болезней и предупреждают преждевременное поседение волос.
В Медицине.
Кобальт в медицине используется, в лечении радиоактивным излучением злокачественных опухолей. На данный момент для облучения тканей, пораженных раком, применяется радиоактивный изотоп кобальта 60Со, который дает самое однородное излучение (в случаях, когда подобное лечение возможно).
В медицине соли кобальта в составе витаминно-минерапьных комплексов используются для лечения и профилактики различных заболеваний. В России синтезирован аспарагинат кобальта — легко усвояемая соль этого микроэлемента.
Содержащий кобальт витамин В12 (кобаламин), один из широко распространенных витаминов, применяемых в медицинских целях. Кобаламин используют при лечении анемий: постгеморрагических и железодефицитных, вызванных токсическими и лекарственными веществами, апластических у детей. Этот витамин применяют также при многих заболеваниях нервной системы, кожных болезнях и ряде других патологических процессов. Хлористый кобальт в виде 20% раствора используется при лечении гипертонической болезни. Радиоактивные изотопы кобальта применяются в радиоизотопной диагностике и для лучевой терапии (Со-60).
В технике и медицине в качестве источника гамма-излучения используется 60Со. Этот изотоп используется в медико-биологических исследованиях в качестве индикатора при исследовании динамики биохимических процессов.
Бефунгин.
Международное название: Чаги экстракт+Кобальта хлорид.
Лекарственная форма: раствор для приема внутрь
Фармакологическое действие: Бефунгин - препарат растительного происхождения, действие которого обусловлено эффектами входящих в его состав биологически активных веществ...
Показания: Хронический гастрит, атония ЖКТ, язвенная болезнь желудка. В качестве симптоматического ЛС: рак различной локализации.
КОАМИД (Соаmidum).
Дихлорникотинамид-кобальт.
Порошок светло-фиолетового цвета, горький на вкус, без запаха. Легко растворим в воде; рН 1 % водного раствора 5, 5 - 6, 5.
Кобальт является стимулятором кроветворения, способствует усвоению организмом железа и стимулирует процессы его преобразования (образование белковых комплексов, синтез гемоглобина и др.), нормализует эритропоэтическую активность и ведет к ликвидации анемий.
Препарат легко всасывается и хорошо переносится больными.
Применяют коамид для лечения гипохромных анемий, гипопластических анемий и др., в том числе сидеробластных (сидероахрестических) анемий; резистентных к препаратам железа (См. также Цианокобаламин, Ферковен.). При необходимости назначают препараты железа одновременно с коамидом.
Вводят под кожу в виде 1 % водного раствора по 1 мл ежедневно. Можно также назначать внутрь по 0, 1 г 3 раза в день.
Продолжительность лечения зависит от характера заболевания и получаемых результатов; в среднем курс лечения продолжается 25 - 30 дней.
Формы выпуска: порошок; 1 % раствор в ампулах по 1 мл в упаковке по 10 ампул.
В небольших количествах (доли миллиграмма) сульфат кобальта входит в состав некоторых комбинированных поливитаминных таблеток (см. Компливит, Олиговит и др.).
Цианокобаламин.
Действующее вещество:
Цианокобаламин* (Cyanocobalaminum)
Показания:
Анемии (Аддисона-Бирмера, алиментарная макроцитарная, железодефицитная, постгеморрагическая, апластическая, вызванная токсическими веществами и лекарственными препаратами), цирроз печени, гепатит, миелоз, полиневрит, радикулит, невралгия тройничного нерва, боковой амиотрофический склероз, детский церебральный паралич, рассеянный склероз, болезнь Дауна, кожные заболевания, травмы периферических нервов.
Противопоказания:
Тромбоэмболия, стенокардия.
Побочные действия:
Возбуждение, боли в области сердца, тахикардия, аллергические реакции.
Источники кобальта.
Микроэлемент кобальт поступает в наш организм в основном с продуктами питания. Нужно отметить, что основную его дозу мы получаем из продуктов, которые богаты витамином В12.
Наибольшее его количество содержится в говядине, печени (особенно телячьей), редисе, винограде, шпинате, салате, черной смородине, клюкве, свежем огурце, репчатом луке, молоке и яйцах.
Есть кобальт в фасоли, картофеле, крупах, хлебе, капусте белокочанной и зеленом горошке, в рыбных продуктах. Небольшое количество кобальта содержится в молочных продуктах, кроме сыра. Большое количество кобальта содержат какао и чай.
Разнообразное питание обеспечивает наш организм оптимальным содержанием кобальта.
Недостаток кобальта.
Нехватка кобальта в человеческом организме может стать причиной развития серьезных заболеваний. Такой дефицит чаще всего встречается у вегетарианцев, спортсменов, которые подвержены повышенным физическим нагрузкам, при проблемах с органами желудочно-кишечного тракта, а также в случае большой потери крови и при некоторых видах глистов. Причиной нехватки кобальта могут стать операции на желудке, атрофический гастрит, язва, энтероколит.
Среди других причин можно назвать его недостаточное поступление с продуктами питания, пониженную кислотность желудочного сока, дефицит витамина В12, снижение функции поджелудочной железы и нарушение регуляции обмена.
Недостаток кобальта может привести к акобальтозу. Нехватка кобальта в некоторых случаях может стать причиной дефицита витамина В12. Такой дефицит может привести к развитию злокачественной анемии, т.е., онкологии крови.
Дефициту этого микроэлемента подвержены курильщики, люди, имеющие хронические расстройства стула, а также пожилые люди.
Симптомы нехватки кобальта.
Недостаточное потребление этого микроэлемента проявляется возникновением ряда нарушений со стороны центральной нервной системы, утомляемостью, снижением памяти, общей слабостью, аритмией, вегетососудистыми нарушениями, а также ухудшением аппетита, медленным выздоровлением после заболеваний, замедленным развитием в детском возрасте и развитием анемии.